题目内容
工业制钛白粉产生的废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可利用酸解法生产补血剂乳酸亚铁。其生产流程如下:

已知:TiOSO4可溶于水,在水中电离为TiO2+和SO42-。请回答下列问题:
(1)写出TiOSO4水解生成钛酸H4TiO4的离子方程式 。步骤①中加入足量铁屑的目的是 。
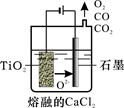
(2)工业上由H4TiO4可制得钛白粉TiO2。TiO2直接电解还原法(剑桥法)生产钛 是一种较先进的方法,电解质为熔融的CaCl2,原理如图所示,阴极的电极反应为_______________。
(3)步骤②的离子方程式是 ,所得副产品主要 是__________(填化学式)。
(4)步骤④的结晶过程中必须控制一定的真空度,原因是 。
(5)乳酸可由乙烯经下列步骤合成:
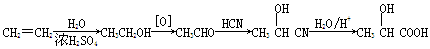
上述合成路线的总产率为60%,乳酸与碳酸亚铁反应转化为乳酸亚铁晶体的产率为90%,则生产468 kg乳酸亚铁晶体(M=234 g/mol)需要标准状况下的乙烯 m3。

已知:TiOSO4可溶于水,在水中电离为TiO2+和SO42-。请回答下列问题:
(1)写出TiOSO4水解生成钛酸H4TiO4的离子方程式 。步骤①中加入足量铁屑的目的是 。
(2)工业上由H4TiO4可制得钛白粉TiO2。TiO2直接电解还原法(剑桥法)生产钛 是一种较先进的方法,电解质为熔融的CaCl2,原理如图所示,阴极的电极反应为_______________。

(3)步骤②的离子方程式是 ,所得副产品主要 是__________(填化学式)。
(4)步骤④的结晶过程中必须控制一定的真空度,原因是 。
(5)乳酸可由乙烯经下列步骤合成:
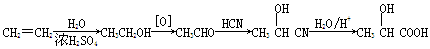
上述合成路线的总产率为60%,乳酸与碳酸亚铁反应转化为乳酸亚铁晶体的产率为90%,则生产468 kg乳酸亚铁晶体(M=234 g/mol)需要标准状况下的乙烯 m3。
(1)TiO2++3H2O H4TiO4+2H+;将溶液中的Fe3+还原为Fe2+,消耗溶液中的H+促进TiO2+水解(2)TiO2+4e-==Ti+2O2-(3)Fe2++2HCO3-==FeCO3↓+CO2↑+H2O;(NH4)2SO4(4)防止Fe2+被空气中的氧气氧化(5)165.9
H4TiO4+2H+;将溶液中的Fe3+还原为Fe2+,消耗溶液中的H+促进TiO2+水解(2)TiO2+4e-==Ti+2O2-(3)Fe2++2HCO3-==FeCO3↓+CO2↑+H2O;(NH4)2SO4(4)防止Fe2+被空气中的氧气氧化(5)165.9
 H4TiO4+2H+;将溶液中的Fe3+还原为Fe2+,消耗溶液中的H+促进TiO2+水解(2)TiO2+4e-==Ti+2O2-(3)Fe2++2HCO3-==FeCO3↓+CO2↑+H2O;(NH4)2SO4(4)防止Fe2+被空气中的氧气氧化(5)165.9
H4TiO4+2H+;将溶液中的Fe3+还原为Fe2+,消耗溶液中的H+促进TiO2+水解(2)TiO2+4e-==Ti+2O2-(3)Fe2++2HCO3-==FeCO3↓+CO2↑+H2O;(NH4)2SO4(4)防止Fe2+被空气中的氧气氧化(5)165.9试题分析:(1)根据水解原理:盐+水=酸+碱,则TiOSO4水解生成钛酸H4TiO4的离子方程式TiO2++3H2O
 H4TiO4+2H+;将溶液中的Fe3+还原为Fe2+,消耗溶液中的H+促进TiO2+水解(2)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,故阴极电极反应:TiO2+4e-==Ti+2O2-(3)NH4HCO3在溶液中电离出HCO3-离子,易电离生成碳酸根,碳酸根和亚铁离子反应生成FeCO3促进HCO3-电离,故离子方程式Fe2++2HCO3-==FeCO3↓+CO2↑+H2O;所得的副产物为溶液中没有参加反应的铵根离子和硫酸根离子形成的(NH4)2SO4;(4)亚铁离子易被氧气氧化,所以步骤⑥必须控制一定的真空度,这样有利于蒸发水还能防止Fe2+被氧化;(5)由题意知,乳酸生成乳酸亚铁的摩尔比为2:1,设需要乙烯x m3,则反应生成468kg乳酸亚铁晶体所需乙烯为
H4TiO4+2H+;将溶液中的Fe3+还原为Fe2+,消耗溶液中的H+促进TiO2+水解(2)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,故阴极电极反应:TiO2+4e-==Ti+2O2-(3)NH4HCO3在溶液中电离出HCO3-离子,易电离生成碳酸根,碳酸根和亚铁离子反应生成FeCO3促进HCO3-电离,故离子方程式Fe2++2HCO3-==FeCO3↓+CO2↑+H2O;所得的副产物为溶液中没有参加反应的铵根离子和硫酸根离子形成的(NH4)2SO4;(4)亚铁离子易被氧气氧化,所以步骤⑥必须控制一定的真空度,这样有利于蒸发水还能防止Fe2+被氧化;(5)由题意知,乳酸生成乳酸亚铁的摩尔比为2:1,设需要乙烯x m3,则反应生成468kg乳酸亚铁晶体所需乙烯为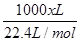 ×0.6×0.9×2=
×0.6×0.9×2=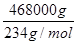 ,x="165.9" m3。
,x="165.9" m3。
练习册系列答案
相关题目
 4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下:
4CuSO4+2Fe2(SO4)3+2H2O。某工厂运用该原理生产铜和绿矾的工艺如下:
 ,则此溶液最多能溶解铁粉的质量为
,则此溶液最多能溶解铁粉的质量为
 3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是 。
3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是 。