题目内容
5.25℃时,KSPMg(OH)2=5.61×10-12,KSP MgF2=7.42×10-11下列说法正确的是( )| A. | 25℃时,固体Mg(OH)2在20ml0.01 mol•L-1氨水中的KSP比20mL0.01 mol•L-1NH4Cl溶液中的KSP小 | |
| B. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的C(Mg)2+大 | |
| C. | 25℃时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 | |
| D. | 25℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,C(Mg2+)增大 |
分析 根据氢氧化镁与氟化镁的化学式相似,由题中数据可知氢氧化镁的溶度积小,其饱和溶液中Mg2+浓度较小;氢氧化镁存在着微弱的电离,产生的氢氧根和氯化铵电离出来的铵根结合,产生一水合氨,使平衡正向移动,所以镁离子的浓度增加;Ksp只与温度有关;不管氢氧化镁的ksp有多小,只要加入的氟化钠溶液的浓度适合的话,使c(Mg2+)×c(F-)2>7.42×10-11,可以使氢氧化镁转化为氟化镁沉淀,据此进行判断.
解答 解:A.溶度积Ksp不随浓度变化,只与温度有关,故A错误;
B.因氢氧化镁溶度积小,所以25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg)2+小,故B错误;
C.Mg(OH)2和MgF2的Ksp接近,使用浓NaF溶液可以使氢氧化镁转化,故C错误;
D.NH4+结合OH-使氢氧化镁溶解平衡正向移动,则溶液中Mg2+增大,故D正确;
故选D.
点评 本题考查难溶电解质的溶解平衡和沉淀转化,题目难度中等,注意掌握难溶电解质的溶解平衡及其影响因素,若比较两种物质的溶度积大小,特别注意的是:不同物质的溶度积比较应应在化学式相似的情况下才具有可比性.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
15.下列有机物分子中,所有原子不可能处于同一平面的是( )
| A. | CH2=CH-CH=CH2 | B. | CH2=CH-C≡CH | C. | 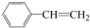 | D. | 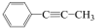 |
13.以下装置工作一段时间后,发现A池中收集到的气体体积不同,如图所示,
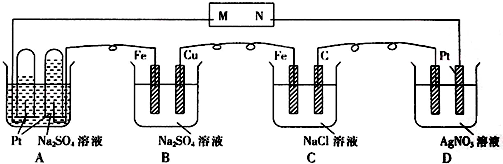
以下有关的推断中正确的( )
①M是电源的负极 ②B中Cu电极的质量减少 ③C中溶液的pH升高
④D中溶液的pH下降 ⑤B中一段时间后溶液出现蓝色沉淀
⑥相同条件下的A,C,D池中生成气体的总体积为C>A>D.

以下有关的推断中正确的( )
①M是电源的负极 ②B中Cu电极的质量减少 ③C中溶液的pH升高
④D中溶液的pH下降 ⑤B中一段时间后溶液出现蓝色沉淀
⑥相同条件下的A,C,D池中生成气体的总体积为C>A>D.
| A. | 只有⑤⑥ | B. | 只有③④⑤⑥ | C. | 全部 | D. | 除② |
10.硫化氢与二氧化硫反应生成了32g单质硫,则氧化产物和还原产物的质量之比是( )
| A. | 1:2 | B. | 1:3 | C. | 1:1 | D. | 2:1 |
17.下列有机化合物分子中所有的碳原子不可能处于同一平面的是( )
| A. | CH3CH2CH2CH2CH2CH3 | B. | CH3CH2CH2COCH3 | ||
| C. | CH2=CH-CH=CH2 | D. | (CH3)3C-C≡C-CH=CHCH3 |
14.下列说法正确的是( )
| A. | 硅被用来制造高性能的现代通讯材料----光导纤维 | |
| B. | 水晶和餐桌上的瓷盘都是硅酸盐制品 | |
| C. | 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 | |
| D. | 硅酸铜钡(化学式为BaCuSi2O6)用氧化物形式表示为BaO…CuO•SiO2 |
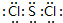 ,它在常温下呈液态,形成晶体时,属于分子晶体.
,它在常温下呈液态,形成晶体时,属于分子晶体.