题目内容
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2若CuFeS2中Fe的化合价为+2,反应中被还原的元素是____________(填元素符号)。
8Cu+4FeO+2Fe2O3+16SO2若CuFeS2中Fe的化合价为+2,反应中被还原的元素是____________(填元素符号)。
(2)冶炼铜的主要流程如下:

气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液
用稀HNO3浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,一位同学由此得出该熔渣中铁元素价态为+3的结论。请指出该结论是否合理并说明理由________。
(3)冶炼出的铜可以发生下列反应
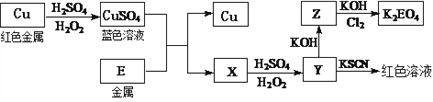
写出Cu溶于稀H2SO4和H2O2混合液的离子方程式:___________________。
写出Cl2将Z氧化为K2EO4的化学方程式:_____________________。
对于0.1molL-1 CuSO4溶液,正确的是_______
A、常温下,pH>7
B、 c(Cu2+)>c(SO42―)>c(H+)>c(OH―)
C、c(H+)+2 c(Cu2+)= 2c(SO42―)+c(OH―)
【答案】 Cu、O c 该结论不正确。稀HNO3有强氧化性,若该铁的价态为+2价,则被氧化为+3价同样可使KSCN溶液变血红色。 Cu + H2O2 + 2H+ == Cu2+ + 2H2O 10KOH + 3Cl2 + 2Fe(OH)3 == 2K2FeO4 + 6KCl + 8H2O C
【解析】(1)8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2中,Fe元素的化合价升高,Cu、O元素的化合价降低,则Cu、O元素被还原;
8Cu+4FeO+2Fe2O3+16SO2中,Fe元素的化合价升高,Cu、O元素的化合价降低,则Cu、O元素被还原;
(2)①由流程图转化可知,气体A中的大气污染物主要是二氧化硫,选择试剂吸收二氧化硫,不能产生新的污染气体;a.浓H2SO4不能吸收二氧化硫,故A错误;b.稀HNO3可以吸收二氧化硫,但生成NO污染大气,故B错误;c.NaOH溶液与二氧化硫反应生成亚硫酸钠,故C正确;故选c;
②用稀HNO3浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明含有Fe3+,但无法由此得出该熔渣中铁元素价态为+3的结论,因为稀HNO3有强氧化性,若该铁的价态为+2价,则被氧化为+3价同样可使KSCN溶液变血红色;
(3)Cu溶于稀H2SO4和H2O2混合液渗出硫酸铜与水,离子方程式为:Cu+2H++H2O2=Cu2++2H2O;
Cl2将氢氧化铁氧化为高铁酸钾、氯化钾和水,反应方程式为:10KOH+3Cl2+2Fe(OH)3=2K2FeO4+6KCl+8H2O;
A.Cu2+水解,溶液显酸性,则常温下pH<7,故A错误;B.Cu2+水解,溶液显酸性,则 c(SO42―)>c(Cu2+)>c(H+)>c(OH―),故B错误;C.溶液中存在的电荷守恒式为c(H+)+2 c(Cu2+)= 2c(SO42―)+c(OH―),故C正确;答案为C。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案