题目内容
(9分)有如下两个反应(反应所需的其他条件和各物质的化学计量数均已略去):
①X+Y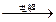 Z+P+Q;②Z+Q
Z+P+Q;②Z+Q X+H+Y。请针对以下两种不同情况来完成:
X+H+Y。请针对以下两种不同情况来完成:
(1)若X是一种日常生活中用作调味剂的盐,反应①是化学工业上制取单质Q和化合物Z的重要方法。则Z的电子式为___________________;反应①中阴极反应为___________________;反应②的离子方程式为______________;在酸性条件下,若将化合物H加到含Fe2+的溶液中,溶液从浅绿色变成黄色,该反应的离子方程式为_______________________________________。
(2)若X是一种含氧酸盐,可用于实验室中检验水的存在。1个X的酸根离子中共含有50个电子,其中含有一种元素R,R的原子最外层电子数是电子层数的2倍,则R在元素周期表中的位置是_________。X单质的熔点是112.8 ℃,则R单质的晶体类型属于______晶体。
(3)若X是(2)中的含氧酸盐,当以石墨作电极电解X溶液时,阳极反应为___________________;原溶液体积为1升,C(H+)=1×10-6mol/L。电解一段时间,当阳极收集到56ml(标况下)气体是,假定溶液体积不变,阴极棒将增重______g,此时电解质溶液的PH为_____。
①X+Y
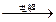 Z+P+Q;②Z+Q
Z+P+Q;②Z+Q X+H+Y。请针对以下两种不同情况来完成:
X+H+Y。请针对以下两种不同情况来完成:(1)若X是一种日常生活中用作调味剂的盐,反应①是化学工业上制取单质Q和化合物Z的重要方法。则Z的电子式为___________________;反应①中阴极反应为___________________;反应②的离子方程式为______________;在酸性条件下,若将化合物H加到含Fe2+的溶液中,溶液从浅绿色变成黄色,该反应的离子方程式为_______________________________________。
(2)若X是一种含氧酸盐,可用于实验室中检验水的存在。1个X的酸根离子中共含有50个电子,其中含有一种元素R,R的原子最外层电子数是电子层数的2倍,则R在元素周期表中的位置是_________。X单质的熔点是112.8 ℃,则R单质的晶体类型属于______晶体。
(3)若X是(2)中的含氧酸盐,当以石墨作电极电解X溶液时,阳极反应为___________________;原溶液体积为1升,C(H+)=1×10-6mol/L。电解一段时间,当阳极收集到56ml(标况下)气体是,假定溶液体积不变,阴极棒将增重______g,此时电解质溶液的PH为_____。
(1) ;2H++2e-=H2↑;Cl2+2OH-====Cl-+ClO-+H2O
;2H++2e-=H2↑;Cl2+2OH-====Cl-+ClO-+H2O
2Fe2++ClO-+2H+====2Fe3++Cl-+H2O
(2)第三周期第ⅥA族;分子
(3)4OH--4e-=2H2O+O2↑;0.64g;2(每空1分)
 ;2H++2e-=H2↑;Cl2+2OH-====Cl-+ClO-+H2O
;2H++2e-=H2↑;Cl2+2OH-====Cl-+ClO-+H2O2Fe2++ClO-+2H+====2Fe3++Cl-+H2O
(2)第三周期第ⅥA族;分子
(3)4OH--4e-=2H2O+O2↑;0.64g;2(每空1分)
(1)由“日常生活中用作调味剂的盐”可判断X是氯化钠,电解饱和食盐水是化学工业上制取氯气(Q)和氢氧化钠(Z)的重要方法,说明X是氯化钠的判断正确。氯气与氢氧化钠溶液反应生成次氯酸钠(H)、氯化钠(X)和水(Y),由于次氯酸钠是常见的强氧化剂,亚铁离子是常见的还原剂,根据“溶液从浅绿色变成黄色”判断氧化产物为铁离子,次氯酸根离子中的氯元素显+1价,得电子化合价降低,若降为0价生成的氯气可以氧化亚铁离子进一步降至-1价,因此次氯酸根离子的还原产物应为氯离子,根据得失电子守恒和电荷守恒就可以配平。
(2)实验室常用无水硫酸铜检验水的存在,1个硫酸根离子恰好含50个电子,其中的硫元素最外层电子数是6,电子层数是3,R为硫,位于元素周期表第三周期第ⅥA族。非金属单质硫的熔点较低可判断为分子晶体。
(3)通过第2小题分析明确了是电解硫酸铜溶液,则阳极电解氢氧跟。根据得失电子守恒算出阴极析出的铜的质量。而阳极电解了多少氢氧跟就可产生多少氢离子,从而算出电解后的PH
(2)实验室常用无水硫酸铜检验水的存在,1个硫酸根离子恰好含50个电子,其中的硫元素最外层电子数是6,电子层数是3,R为硫,位于元素周期表第三周期第ⅥA族。非金属单质硫的熔点较低可判断为分子晶体。
(3)通过第2小题分析明确了是电解硫酸铜溶液,则阳极电解氢氧跟。根据得失电子守恒算出阴极析出的铜的质量。而阳极电解了多少氢氧跟就可产生多少氢离子,从而算出电解后的PH

练习册系列答案
相关题目
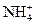 、Ca2+等,进行以下实验(所加酸、碱、氨水、溴水都是过量的)。
、Ca2+等,进行以下实验(所加酸、碱、氨水、溴水都是过量的)。