题目内容
【题目】硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害。
Ⅰ.已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)===BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1
BaS(s)===Ba(s)+S(s) ΔH=+460 kJ·mol-1
已知:2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
则:Ba(s)+S(s)+2O2(g)===BaSO4(s) ΔH=________。
Ⅱ.SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法
反应原理:恒温恒容时2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。
S2(g)+2CO2(g)。
反应进行到不同时间测得各物质的浓度部分图像如图:
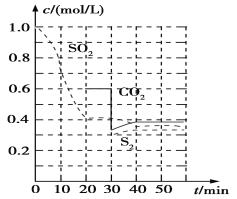
①0~20 min反应速率表示为v(SO2)=________;
②30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是________;
③40 min时,平衡常数K=________。
(2)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为__________________;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是________(填序号)。
a.c(Na+)+c(H+)>c(SO![]() )+c(HSO
)+c(HSO![]() )+c(OH-)
)+c(OH-)
b.水电离出c(H+)=1×10-8 mol/L
c.c(Na+)>c(HSO![]() )>c(H+)>c(SO
)>c(H+)>c(SO![]() )
)
(3)电化学处理法
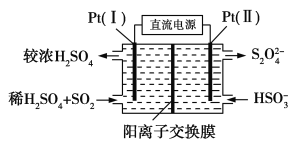
①如图所示,Pt(Ⅰ)电极的反应式为__________________;
②当电路中转移0.02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加________mol离子。
【答案】Ⅰ.-1473.2 kJ·mol-1
Ⅱ.(1)①0.03 mol/(L·min)②减少CO2的浓度 ③0.675
(2)①SO32-+SO2+H2O=2HSO3-②ac
(3)①SO2-2e-+2H2O===SO42-+4H+ ②0.03
【解析】
试题分析:Ⅰ.已知:①BaSO4(s) +4C(s)=BaS(s) +4CO(g) ΔH=+571.2 kJ·mol-1
②BaS(s)=Ba(s)+S(s) ΔH=+460 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1,根据盖斯定律分析,反应③×2-反应①-反应②可得热化学方程式为Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH=-221×2-460-571.2=-1473.2 kJ·mol-1。
Ⅱ.(1)①由图可知,0~20分钟内二氧化硫浓度变化量为1mol/L-0.4mol/L=0.6mol/L,故二氧化硫的反应速率=0.6mol/L÷20min=0.03 mol/(L·min)。
②30分钟时瞬间,二氧化碳的浓度降低,S2的浓度不变,而后二氧化碳和S2的浓度均增大,应是减小二氧化碳的浓度。
③其平衡常数为生成物的浓度幂之积/反应物浓度的幂之积,由于平衡常数只与温度有关系,则K= c(S2)c2(CO2)/c2(SO2)=![]() =0.675。
=0.675。
(2)①亚硫酸钠溶液与二氧化硫反应生成亚硫酸氢钠,反应离子方程式为SO32-+SO2+H2O=2HSO3- 。
②a.根据电荷守恒,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),所以c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-),a正确。b.水电离出的氢离子浓度等于水电离出的氢氧根离子浓度,由于亚硫酸氢钠溶液的pH未知,所以不能计算水电离出c(H+)浓度,b错误。c.在亚硫酸氢钠溶液中亚硫酸氢根的电离大于水解,所以离子浓度关系为c(Na+)>c(HSO3-)>c(H+)>c(SO32-),c正确。所以选ac。
(3)①由图可知,Pt(Ⅰ)电极上也好了氧化成硫酸,电极反应为SO2-2e-+2H2O=SO42-+4H+。
②左侧电解反应SO2-2e-+2H2O=SO42-+4H+,根据电子守恒,生成硫酸根的物质的量为0.02mol/2=0.01mol,生成氢离子物质的量为0.04mol,为保持溶液电中性,0.01mol的硫酸根需要0.02mol÷的氢离子,多余的氢离子通过阳离子交换膜移动到右侧,即有0.02mol氢离子移动到右侧,故左侧溶液中增加的离子为0.01mol+0.02mol=0.03mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案