题目内容
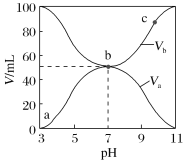
【题目】已知H2A为二元弱酸。室温时,配制一组c(H2A)+c(HA-) +c(A2-)=0. 100mol·L-1的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如下图所示。下列指定溶液中微粒的物质的量浓度关系不正确的是

A. pH=2 的溶液中:c(H2A)+c(A2-)>c(HA- )
B. E点溶液中:c(Na+)-c(HA-)< 0. 100 mol L-1
C. c(Na+)= 0.100 mol·L-1的溶液中:c(H+) + c(H2A)=c(OH-)+c(A2-)
D. pH=7的溶液中:c(Na+)>2c(A2- )
【答案】A
【解析】A、根据图像,可以得知pH=2时c(HA-)>c(H2A)+c(A2-),故A说法错误;B、E点:c(A2-)=c(HA-), 根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),此时的溶质为Na2A、NaHA,根据物料守恒,2n(Na+)=3n(A),即2c(Na+)=3c(A2-)+3c(HA-)+3c(H2A),两式合并,得到c(Na+)-c(HA-)=[c(HA-)+3c(H2A)+c(A2-)]/2,即c(Na+)-c(HA-)=0.1+c(H2A),c(Na+)-c(HA-)< 0. 100 mol·L-1,故B说法正确;C、根据物料守恒和电荷守恒分析,当c(Na+)=0.1mol·L-1溶液中:c(H+) + c(H2A)=c(OH-)+c(A2-),故C说法正确;D、根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),pH=7,说明c(H+)=c(OH-),即c(Na+)=c(HA-)+2c(A2-),因此有c(Na+)>2c(A2- ),故D说法正确。