题目内容
【题目】我国有广阔的海岸线,海水综合利用大有可为.海水中Br﹣含量为65mgL﹣1,从海水中提取溴的工业流程如下:

(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是:_______.
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的___(填序号).
A.氧化性B.还原性C.挥发性D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
___Br2+ CO32﹣═ BrO3﹣+ Br﹣+ CO2↑
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.写出溴蒸气与二氧化硫水溶液反应的离子方程式:___________.
(5)实验室从溴水中分离出溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是____(填序号).
A.乙醇B.四氯化碳C.裂化汽油 D.苯
(6)用上述流程制得含Br265%的工业溴1t,至少需要海水_____m3.
(7)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.写出溴与二氧化硫水溶液反应的离子方程式:__________________.
【答案】 富集溴元素 C 3;3;1;5;3; SO2+Br2+2H2O=4H++2Br﹣+SO42﹣ BD 2.0×104 SO2+Br2+2H2O=4H++2Br﹣+SO42﹣.
【解析】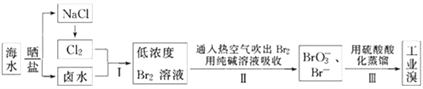
根据流程分析可知:海水通过晒盐得到氯化钠和卤水,卤水加入氧化剂氯气氧化溴离子为单质溴,得到低浓度Br2的溶液,通入热空气或水蒸气吹出Br2,用纯碱溶液吸收得到含Br-和BrO3-的混合溶液,再利用酸溶液中溴酸根离子和溴离子发生氧化还原反应得到溴单质,蒸馏利用的是溴单质的易挥发性,据此分析解答。
(1)步骤Ⅰ中已获得游离态的溴浓度很低,如果直接蒸馏,生产成本较高,不利于工业生产,步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是富集溴元素,降低成本;(2)溴易挥发,步骤Ⅱ通入热空气或水蒸气吹出Br2,就是利用溴的挥发性,故选C;(3)该反应中Br元素化合价由0价变为-1价、+5价,其最小公倍数是5,再结合原子守恒或电荷守恒得方程式为3Br2+3CO32-=BrO3-+5Br-+3CO2↑;(4)上述流程中吹出的溴蒸气,也可以用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.溴与二氧化硫水溶液反应生成硫酸和溴化氢,反应的化学方程式为:Br2+SO2+2H2O=2HBr+H2SO4,离子方程式:SO2+Br2+2H2O=4H++2Br-+SO42-;(5)萃取剂的选取标准:萃取剂和溶质不反应、溶质在萃取剂中的溶解度大于在原溶剂中的溶解度、萃取剂和原溶剂不互溶,A.乙醇易溶于水,所以不能作萃取剂,A错误;B.四氯化碳符合萃取剂选取标准,所以能作萃取剂,B正确;C.裂化汽油和溴能发生加成反应,所以不能作萃取剂,C错误;D.苯符合萃取剂选取标准,所以能作萃取剂,D正确;答案选BD;(6)用上述流程制得含Br265%的工业溴1t,含溴元素质量=1t×65%×2=1.3t=1.3×109mg,海水中Br-含量为65mgL-1,溴元素守恒,则海水的体积=1.3×109mg/65mg/L=2.0×107L=2.0×104m3;(7)溴具有强氧化性、二氧化硫具有还原性,二者在水溶液中混合易发生氧化还原生成氢溴酸和硫酸,反应的离子方程式为SO2+Br2+2H2O=4H++2Br-+SO42-。





