题目内容
【题目】氯气和氨气在常温下混合即可发生反应。某兴趣小组同学为探究纯净、干燥的氯气与氨气的反应,设计了如下装置:
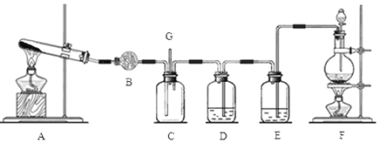
(1)装置F中发生反应的离子方程式是 ;
(2)装置D中盛放的试剂是 ,其作用是 ;
(3)A装置还可用于制取气体 (只填一种);
(4)若有10.7gNH4Cl,最多可制取标准状况下的氨气的体积是 L;
(5)装置C中有白烟产生,试写出反应的化学方程式 ;
(6)G处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有 的洗气瓶。
【答案】(1)MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)浓硫酸;干燥氯气;(3)O2;(4)4.48;
(5)NH3+HCl=NH4Cl;(6)NaOH溶液。
【解析】(1)F是浓盐酸与二氧化锰混合加热制取氯气的装置,其中发生反应的离子方程式是MnO2 + 4H+ + 2Cl-![]() Mn2+ + Cl2↑+ 2H2O;(2)由于浓盐酸具有挥发性,所以制取的氯气中含有杂质HCl及水蒸气,在装置E中用饱和食盐水除去HCl,在装置D中用浓硫酸除去其中的水蒸气,所以盛放的试剂是浓硫酸;其作用是干燥氯气;(3) A装置适用于固体混合加热制取气体,因此还可用于制取气体是氧气;(4)10.7g NH4Cl的物质的量是n(NH4Cl)=10.7g÷53.5g/mol=0.2mol,则根据方程式可知反应产生氨气的物质的量也是0.2mol,其在标准状况下的体积是V(NH3)=0.2mol×22.4 L/mol= 4.48L;(5) 若有C中有白烟产生,反应的化学方程式是NH3+HCl==NH4Cl;(6) G处逸出的尾气中含有少量Cl2,由于氯气与碱发生反应,产生可溶性的盐,所以为防止其污染环境,可将尾气通过盛有NaOH溶液的洗气瓶。
Mn2+ + Cl2↑+ 2H2O;(2)由于浓盐酸具有挥发性,所以制取的氯气中含有杂质HCl及水蒸气,在装置E中用饱和食盐水除去HCl,在装置D中用浓硫酸除去其中的水蒸气,所以盛放的试剂是浓硫酸;其作用是干燥氯气;(3) A装置适用于固体混合加热制取气体,因此还可用于制取气体是氧气;(4)10.7g NH4Cl的物质的量是n(NH4Cl)=10.7g÷53.5g/mol=0.2mol,则根据方程式可知反应产生氨气的物质的量也是0.2mol,其在标准状况下的体积是V(NH3)=0.2mol×22.4 L/mol= 4.48L;(5) 若有C中有白烟产生,反应的化学方程式是NH3+HCl==NH4Cl;(6) G处逸出的尾气中含有少量Cl2,由于氯气与碱发生反应,产生可溶性的盐,所以为防止其污染环境,可将尾气通过盛有NaOH溶液的洗气瓶。