题目内容
如图所示的装置中,烧瓶中充满了干燥气体A将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。
| A(干燥气体)NO2 | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 4mol/LnaOH溶液 |
| C | Cl2 | 饱和NaCl溶液 |
| D | NH3 | 1mol/L盐酸 |
(1)选项_____________(填A、B、C、D)为何不满足要求_____________.
(2)能形成图示喷泉实验的气体和液体甚多,它们需满足的条件是①____________;②____________________。
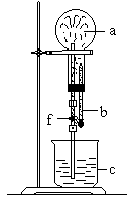
例如________气体和________液体。
(1)A、C;前者与水反应后生成NO,溶液不能充满整个烧瓶.后者气体不溶于液体.(2)①气体易溶于液体②气体与液体反应(无新气体产生);Cl2和NaOH溶液。
解析:
形成喷泉最根本的原因是瓶内外存在压强差。当烧瓶内气体溶于液体并与之反应时,瓶内气体大量减少,压强降低,外界的大气压将液体压入烧瓶内。如此持续,最后液体将充满烧瓶。B和D正确.NO2气体虽也易溶于水,但同时产生NO气体:3NO2+H2O =2HNO3+NO,即使会出现“喷泉”现象,但烧杯内的水只会部分进入烧瓶内,不会几乎充满烧瓶。
饱和氯化钠溶液不能吸收氯气,所以选项A和C错误。
从以上分析我们可知;当气体极易溶于液体或气体与液体反应(一般无新气体产生)即可形成“喷泉”,例如:Cl2和NaOH溶液等。

(13分)中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
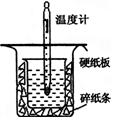
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是_________ _,除此之外,装置中的一个明显错误是 。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于________ ___。
(3)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量 (填“相等”、“不相等”),若实验操作均正确,则所求中和热 填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:________。 (从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)使硫酸与NaOH溶液混合均匀的正确操作是:________。 (从下列选出)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃棒轻轻地搅动
(6)实验数据如下表:
①请填写下表中的空白:
|
温度 实验次数 |
起始温度t1℃ |
终止温度t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
|
2 |
27.0 |
27.4 |
27.2 |
32.3 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
|
4 |
26.4 |
26.2 |
26.3 |
29.8 |
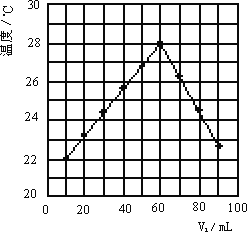
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=______ ____ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____ ____。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
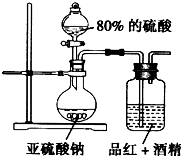 某研究性学习小组的同学决定通过实验探究SO2的漂白性是SO2本身具有的还是SO2与水作用的产物具有的,他们查阅资料知品红能溶解在酒精中形成红色溶液.
某研究性学习小组的同学决定通过实验探究SO2的漂白性是SO2本身具有的还是SO2与水作用的产物具有的,他们查阅资料知品红能溶解在酒精中形成红色溶液.