题目内容
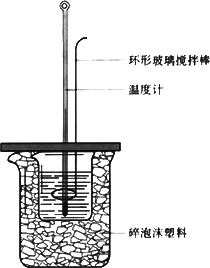
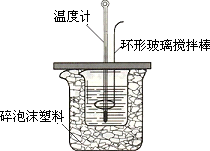
50 ml 1.0 mol·L-1盐酸与50 mL 1.1 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量计算中和热.回答下列问题:

①从实验装置上看,大烧杯上没有________,会导致求得的中和热数值________(填“偏大”“偏小”或“无影响”);实验装置中也缺少环形玻璃搅拌棒,若用环形铜质搅拌棒代替,会导致求得的中和热数值________(填“偏大”“偏小”或“无影响”).
②若实验中分多次把NaOH溶液倒入盛有盐酸的小烧杯中,则求得的中和热数值
(填“偏大”“偏小”或“无影响”)
③若实验中改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),该实验中NaOH溶液的浓度大于盐酸浓度的作用是________.
④若用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会________(填“偏大”“偏小”或“无影响”).
⑤当室温低于10℃时进行实验,对实验结果会造成较大误差,其原因是________.
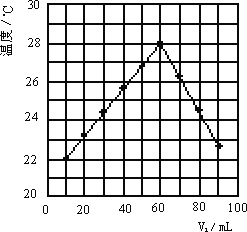
⑥若将V2 mL未知浓度的NaOH溶液,加入内盛有V1 mL 1.0 mol/L HCl溶液的小烧杯中混合均匀后测量并记录溶液温度,且每次实验中均保持V1+V2=10.0 mL,实验结果如图所示(以温度为纵坐标,V1为横坐标).做该实验时环境温度________22℃(填<、=、>),NaOH溶液的浓度约为________mol/L.
解析:
|
①隔热板,偏小;偏小 ②偏小 ③不相等,相等,确保盐酸反应完全 ④偏小 ⑤温差大,散热多. ⑥<,1.5 mol/L(2分) |

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案