题目内容
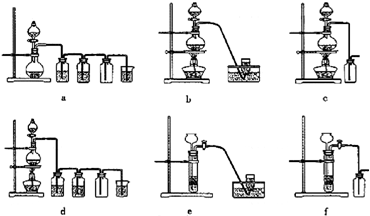
图Ⅰ是实验室中常用于制备和干燥气体的装置: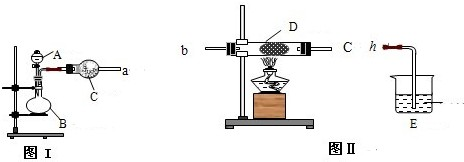
(1)甲同学用图Ⅰ装置、铜和浓硝酸制备并收集干燥的NO2气体:
①B中反应的化学方程式
②收集NO2气体的方法
③将收集满NO2的烧瓶密封浸入冰水中,烧瓶内气体颜色变浅,则下列反应:2NO2(g)?N2O4(g)△H 中的△H
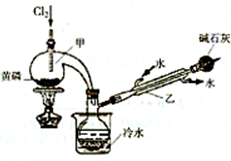
(2)乙同学用图Ⅰ装置制取NH3和O2的混合气体,用图Ⅱ装置验证氨的某些性质,往A中加入浓氨水,B中加入Na2O2固体,C中加入碱石灰,D内放置催化剂(铂石棉),按气流方向a→b→c→h连接各仪器:
①实验中观察到D内有红棕色气体出现,证明氨气具有
②D中反应的化学方程式为
③为防止NO2污染环境,E装置中装的试剂可以是
(2)用图Ⅰ装置制取NH3和O2的混合气体,用图Ⅱ装置验证氨的某些性质,往A中加入浓氨水,B中加入Na2O2固体,反应产生氨气,C中加入碱石灰干燥氨气,D内放置催化剂(铂石棉)使氨气被氧气氧化为一氧化氮,一氧化氮遇氧气生成二氧化氮,二氧化氮是污染性气体不能排放到大气,应进行尾气吸收,通入氢氧化钠溶液中吸收.
(2)装置Ⅰ制备制取干燥的NH3和O2的混合气体,通入装置Ⅱ在D处发生催化氧化反应,4NH3+5O2
| ||
| △ |

PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
|
|
熔点/℃ |
沸点/℃ |
密度/g·mL-1 |
其他 |
|
黄磷 |
44.1 |
280.5 |
1.82 |
2P(过量)+3Cl2 |
|
PCl3 |
-112 |
75.5 |
1.574 |
遇水生成H3PO3和HCl,遇O2生成POCl3 |
|
POCl3 |
2 |
105.3 |
1.675 |
遇水生成H3PO4和HCl,能溶于PCl3 |
如图是实验室制备PCl3的装置(部分仪器已省略)。
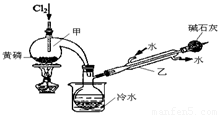
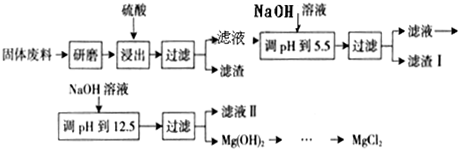
(1)向甲中通入干燥的Cl2之前,需先通入一段时间CO2,目的是 。
(2)实验过程中,应控制 ,以减少PCl5的生成。
(3)粗产品品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过 (填实验操作名称),即可得到PCl3的纯品。
(4)已知:a.H3PO3+H2O+I2
 H3PO4+2HI;b.(NH4)3BO3溶液可与HI和H3PO4反应生成H3BO3(弱酸);c.Na2S2O3溶液可定量测定碘:I2+2Na2S2O3→Na2S4O6+2NaI
H3PO4+2HI;b.(NH4)3BO3溶液可与HI和H3PO4反应生成H3BO3(弱酸);c.Na2S2O3溶液可定量测定碘:I2+2Na2S2O3→Na2S4O6+2NaI
①测定产品中PCl3质量分数的实验如下,请补充相应的实验步骤:
步骤1:迅速移取m g产品,水解完全后在500mL容量瓶中定容。
步骤2:从容量瓶中移取25.00mL溶液置于锥形瓶中。
步骤3:准确加入c1 mol/L碘溶液V1 mL(过量),再 。
步骤4:用标准Na2S2O3溶液回滴过量的碘,将近终点时加入3 mL淀粉溶液,继续滴至终点(蓝色溶液褪色);滴至终点时消耗c2 mol/L Na2S2O3溶液V2 mL。
②根据上述数据,该产品中PCl3的质量分数为 (用含字母的代数式表示)。
PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
|
|
熔点/℃ |
沸点/℃ |
密度/g·mL-1 |
其他 |
|
黄磷 |
44.1 |
280.5 |
1.82 |
2P(过量)+3Cl2 |
|
PCl3 |
-112 |
75.5 |
1.574 |
遇水生成H3PO3和HCl,遇O2生成POCl3 |
|
POCl3 |
2 |
105.3 |
1.675 |
遇水生成H3PO4和HCl,能溶于PCl3 |
如图是实验室制备PCl3的装置(部分仪器已省略)。
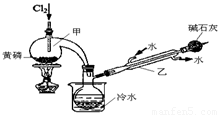
(1)向甲中通入干燥的Cl2之前,需先通入一段时间CO2,目的是 。
(2)实验过程中,应控制 ,以减少PCl5的生成。
(3)粗产品品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过 (填实验操作名称),即可得到PCl3的纯品。
(4)已知:a.H3PO3+H2O+I2
 H3PO4+2HI;b.(NH4)3BO3溶液可与HI和H3PO4反应生成H3BO3(弱酸);c.Na2S2O3溶液可定量测定碘:I2+2Na2S2O3→Na2S4O6+2NaI
H3PO4+2HI;b.(NH4)3BO3溶液可与HI和H3PO4反应生成H3BO3(弱酸);c.Na2S2O3溶液可定量测定碘:I2+2Na2S2O3→Na2S4O6+2NaI
①测定产品中PCl3质量分数的实验如下,请补充相应的实验步骤:
步骤1:迅速移取m g产品,水解完全后在500mL容量瓶中定容。
步骤2:从容量瓶中移取25.00mL溶液置于锥形瓶中。
步骤3:准确加入c1 mol/L碘溶液V1 mL(过量),再 。
步骤4:用标准Na2S2O3溶液回滴过量的碘,将近终点时加入3 mL淀粉溶液,继续滴至终点(蓝色溶液褪色);滴至终点时消耗c2 mol/L Na2S2O3溶液V2 mL。
②根据上述数据,该产品中PCl3的质量分数为 (用含字母的代数式表示)。
 氯水是实验室常需临时配制的一种试剂.图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的可用于向瓶中鼓入空气的仪器).
氯水是实验室常需临时配制的一种试剂.图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的可用于向瓶中鼓入空气的仪器).
 2PCl3;2P+5Cl2(过量)
2PCl3;2P+5Cl2(过量) 2PCl3;2P+5Cl2(过量)
2PCl3;2P+5Cl2(过量)