题目内容
下列递变规律正确的是 ( )
| A.热稳定性:HCl >HF >H2O | B.沸点:金刚石>冰>干冰 |
| C.碱性:NaOH >Mg(OH)2>Ca(OH)2 | D.元素的最高正化合价:F>S>C |
B
非金属性越强,氢化物的稳定性越强,A不正确,应该是HF >H2O> HCl 。金刚石是原子晶体,冰和干冰是分子晶体,水中含有氢键,所以沸点高于干冰的,B正确。金属性越强,最高价氧化物的水化物的碱性越强,C中应该是Ca(OH)2>NaOH >Mg(OH)2。F是最强的非金属,没有正价,D不正确,所以答案选B。

练习册系列答案
相关题目
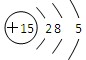 ,则该元素的位置为( )
,则该元素的位置为( )