题目内容
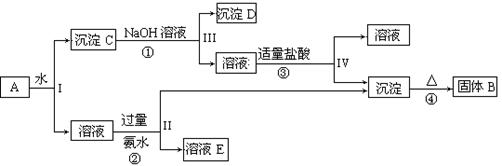
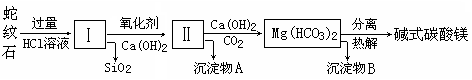
铝、铁、铜及其合金具有广泛的应用,某学校化学兴趣小组为探究金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的AlCl3溶液和胆矾晶体(CuSO4·5H2O),其实验方案如下:

请回答下列问题:
(1)将合金研磨成合金粉的目的是 。
(2)写出步骤I中发生反应的化学方程式: 。
(3)硫酸铜溶液经过“一系列步骤”制得胆矾,此“一系列步骤”依次为 、 和过滤。
(4)在滤液B转化为沉淀E的过程中盐酸的用量不易控制,可将加入适量的盐酸改为通入一种气体,该气体的电子式为 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式: 。
(5)该小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣D中加入稀硫酸和H2O2可制得CuSO4,写出该反应的离子方程式: 。
(6)下面两种方法也可以制备硫酸铜:
方法一:2Cu+O2 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O
方法二:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
假如某工厂欲生产CuSO4,请选择一种方法,并说明理由: 。

请回答下列问题:
(1)将合金研磨成合金粉的目的是 。
(2)写出步骤I中发生反应的化学方程式: 。
(3)硫酸铜溶液经过“一系列步骤”制得胆矾,此“一系列步骤”依次为 、 和过滤。
(4)在滤液B转化为沉淀E的过程中盐酸的用量不易控制,可将加入适量的盐酸改为通入一种气体,该气体的电子式为 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式: 。
(5)该小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣D中加入稀硫酸和H2O2可制得CuSO4,写出该反应的离子方程式: 。
(6)下面两种方法也可以制备硫酸铜:
方法一:2Cu+O2
 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O方法二:Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O假如某工厂欲生产CuSO4,请选择一种方法,并说明理由: 。
(1)增大反应物的接触面积,使反应速率加快(或使反应更充分)(2分)
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑ (2分)
(3)蒸发浓缩、冷却结晶 (2分)
(4)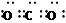 (1分) AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- (2分)
(1分) AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- (2分)
(5)Cu+H2O2+2H+=Cu2++2H2O(2分)
(6)方法一(1分) 硫酸原料利用率高,对环境污染小(2分,回答一点得1分)
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑ (2分)
(3)蒸发浓缩、冷却结晶 (2分)
(4)
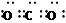 (1分) AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- (2分)
(1分) AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- (2分)(5)Cu+H2O2+2H+=Cu2++2H2O(2分)
(6)方法一(1分) 硫酸原料利用率高,对环境污染小(2分,回答一点得1分)
试题分析:(1)增大反应物的接触面积,使反应速率加快;(2)铝与氢氧化钠反应可看作是先与水反应生成氢氧化铝和氢气,在与碱反应生成偏铝酸钠和水。2Al+2NaOH+2H2O=2NaAlO2+3H2↑(3)蒸发浓缩到有大量晶体析出,然后冷却结晶; (4)盐酸过量会溶解沉淀,通入气体为二氧化碳。电子式为:
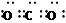 ;反应为强酸制弱酸:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- ;(5)双氧水具有强氧化性,在酸性条件可氧化铜单质:Cu+H2O2+2H+=Cu2++2H2O;(6)方法二,生成有害气体,浪费硫酸
;反应为强酸制弱酸:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- ;(5)双氧水具有强氧化性,在酸性条件可氧化铜单质:Cu+H2O2+2H+=Cu2++2H2O;(6)方法二,生成有害气体,浪费硫酸
练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目


 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2