题目内容
(6分)除去下列物质中的杂质(括号中的物质为杂质),请填表中空白处:
| 物质 | 加入试剂 | 离子方程式 |
| KCl(K2CO3) | . | |
| FeCl3(FeCl2)溶液科 | [ | |
| FeSO4 (CuSO4) 溶液 | | |
HCl 2H++CO32- =H2O + CO2 或 CaCl2 ...
Cl2 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
Fe Fe + Cu2+ = Fe2+ + Cu

Cl2 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
Fe Fe + Cu2+ = Fe2+ + Cu
略

练习册系列答案
相关题目
 12分)过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用。
12分)过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用。 2H2O2 →2H2O+ O2↑.为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为—具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中。
2H2O2 →2H2O+ O2↑.为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为—具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中。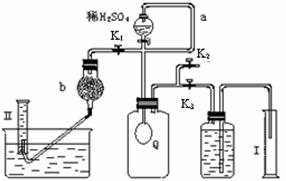
 ____________
____________ _____。
_____。 ,量筒液面高于水槽液面
,量筒液面高于水槽液面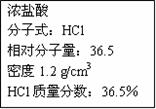

 子转移的方向和数目:
子转移的方向和数目: 为 mL。
为 mL。 必须选用的仪器有(填序号) ,除此还必需的仪器有
必须选用的仪器有(填序号) ,除此还必需的仪器有  )配制过程中,下列情况会使配制溶液的物质的量浓度偏高的是(填序号)
)配制过程中,下列情况会使配制溶液的物质的量浓度偏高的是(填序号)  中转移溶液时不慎有液滴掉在容量瓶外面 。
中转移溶液时不慎有液滴掉在容量瓶外面 。 用容量瓶前检查它是否漏水
用容量瓶前检查它是否漏水
 Cl溶液中少量CaCl2:加入适量Na2CO3,过滤
Cl溶液中少量CaCl2:加入适量Na2CO3,过滤