题目内容
(12分)20 L恒容的密闭容器中,加入3 mol SO3(g)和1 mol氧气,在某温度下使其反应,反应至4 min时,氧气的浓度为0.06 mol/L,当反应到8 min时,反应到达平衡。
(1)0 min~4 min内生成O2的平均速率:
v(O2)=____________mol/(L·min)。
(2)整个过程中,各物质的浓度与时间关系如下图所示,则该温度下的平衡常数K=________________。

(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.05 mol/L的是________,此时的平衡常数与(2)小题比较________(填“大于”、“小于”或“等于”)。
|
|
A |
B |
C |
D |
|
SO3 |
1 mol |
3 mol |
3 mol |
0 mol |
|
SO2 |
2 mol |
1.5 mol |
0 mol |
6 mol |
|
O2 |
2 mol |
1 mol |
0 mol |
5 mol |
(4)物质的浓度不再改变标志该反应已达平衡,下列还可以说明该反应已达平衡的是________(填序号)。
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2)
⑤n(SO3)∶n(O2)∶n(SO2)=2∶1∶2
(1)0.0025 mol·L-1·min-1
(2)0.4 mol·L-1
(3)BD 等于 (4)①③④
【解析】略

(12分)20 L恒容的密闭容器中,加入3 mol SO3(g)和1 mol氧气,在某温度下使其反应,反应至4 min时,氧气的浓度为0.06mol/L,当反应到8 min时,反应到达平衡。
(1)0 min~4min内生成O2的平均速率:
v(O2)=____________mol/(L·min)。
(2)整个过程中,各物质的浓度与时间关系如下图所示,则该温度下的平衡常数K=________________。
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.05 mol/L的是________,此时的平衡常数与(2)小题比较________(填“大于”、“小于”或“等于”)。
|
| A | B | C | D |
| SO3 | 1 mol | 3 mol | 3 mol | 0 mol |
| SO2 | 2 mol | 1.5 mol | 0 mol | 6 mol |
| O2 | 2 mol | 1 mol | 0 mol | 5 mol |
(4)物质的浓度不再改变标志该反应已达平衡,下列还可以说明该反应已达平衡的是________(填序号)。
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2)
⑤n(SO3)∶n(O2)∶n(SO2)=2∶1∶2
(12分)20 L恒容的密闭容器中,加入3 mol SO3(g)和1 mol氧气,在某温度下使其反应,反应至4 min时,氧气的浓度为0.06 mol/L,当反应到8 min时,反应到达平衡。
(1)0 min~4 min内生成O2的平均速率:
v(O2)=____________mol/(L·min)。
(2)整个过程中,各物质的浓度与时间关系如下图所示,则该温度下的平衡常数K=________________。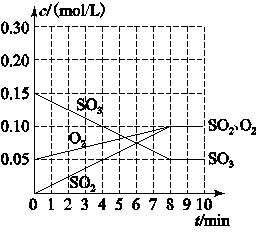
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.05 mol/L的是________,此时的平衡常数与(2)小题比较________(填“大于”、“小于”或“等于”)。
| | A | B | C | D |
| SO3 | 1 mol | 3 mol | 3 mol | 0 mol |
| SO2 | 2 mol | 1.5 mol | 0 mol | 6 mol |
| O2 | 2 mol | 1 mol | 0 mol | 5 mol |
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(SO3)=2v逆(O2)
⑤n(SO3)∶n(O2)∶n(SO2)=2∶1∶2
 2NH3(g); △H=-92.4kJ·mol-1。
2NH3(g); △H=-92.4kJ·mol-1。 
 2NH3(g)的平衡常数K= ________。(保留小数一位)K值越大,表明反应达到平衡时_________(填标号)。
2NH3(g)的平衡常数K= ________。(保留小数一位)K值越大,表明反应达到平衡时_________(填标号)。
 2NH3(g) + O2(g)。△H = a kJ·mol-1 进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表
2NH3(g) + O2(g)。△H = a kJ·mol-1 进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表 
 2NH3(g) ΔH= -92 .4kJ·mol-1
2NH3(g) ΔH= -92 .4kJ·mol-1 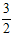 O2(g) ΔH=_____________kJ·mol-1
O2(g) ΔH=_____________kJ·mol-1  O2(g)═H2O(l)△H2=-285.8kJ/mol
O2(g)═H2O(l)△H2=-285.8kJ/mol