题目内容
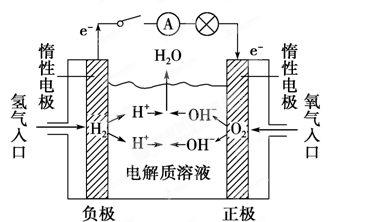
根据下图,下列判断中不正确的是( )
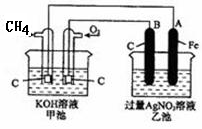

| A.通入O2的电极的电极反应式为:O2 + 2H2O + 4e-= 4OH- |
| B.反应一段时间后,甲池中溶液的pH降低 |
| C.乙池中电极B上发生还原反应 |
| D.当乙池中的某一电极质量增加 10.80g时, 理论上甲池中消耗的气体至少为840mL(标准状况下) |
C
试题分析:根据装置图可知,甲池是甲烷燃料电池,乙池是电解池。原电池中负极失去电子,正极得到电子,所以氧气在正极通入,甲烷在负极通入。则B电极的碳棒是阳极,A电极的铁是阴极。甲池中电解质是氢氧化钾溶液,则通入O2的电极的电极反应式为:O2 + 2H2O + 4e-=4OH-,A正确;甲池中的总反应式是CH4+2KOH+2O2=K2CO3+3H2O,所以反应一段时间后,甲池中溶液的pH降低,选项B正确;电极B是阳极,溶液中的OH-失去电子,发生氧化反应,C不正确;乙池中A电极是溶液中的银离子放电,电极反应式是Ag++e-=Ag。析出银的质量是10.80g,物质的量是0.1mol,转移0.1mol电子,则根据电子的得失守恒可知,消耗甲烷的物质的量是0.1mol÷8=0.0125mol,氧气的物质的量是0.1mol÷4=0.025mol,在标准状况下的体积是(0.025mol+0.0125mol)×22.4L/mol=0.84L=840ml,D正确,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是明确原电池和电解池的工作原理,特别是电极名称、电极反应式、电极产物的判断等,有利于培养学生的逻辑推理能力,提升学生的学科素养。有关电化学的计算,一般根据电子得失守恒进行。

练习册系列答案
 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目