题目内容
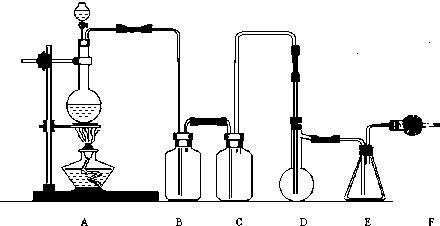
二氯化硫(SCl2)熔点-78°C,沸点59°C,密度1.638g/cm3,遇水易分解,以下是由氯气与硫反应合成二氯化硫的实验装置,其中F中装有无水CaCl2固体.
试回答下列问题:

(1)装置A中发生反应的化学方程式为:
(2)装置C中盛放的试剂是
(3)实验开始前先排尽系统中空气,此做法目的是
(4)实验时,如何防止E中液体挥发
(5)画出虚线框内与F连接的仪器,并指出其中盛装试剂名称,以完善该实验装置.
试回答下列问题:

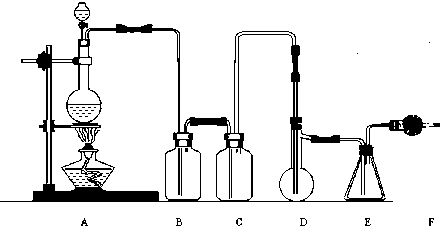
(1)装置A中发生反应的化学方程式为:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
(2)装置C中盛放的试剂是
浓硫酸
浓硫酸
,装置F的作用为防水从后面进入E使二氯化硫分解
防水从后面进入E使二氯化硫分解
(3)实验开始前先排尽系统中空气,此做法目的是
防止加热硫粉时,空气中的氧气与硫粉反应
防止加热硫粉时,空气中的氧气与硫粉反应
再向D中放入一定量的硫粉,加热使之融化,然后摇动烧瓶使硫附着在烧瓶内壁形成一薄层膜,这样做的目的是增大接触面积以加快反应速率
增大接触面积以加快反应速率
(4)实验时,如何防止E中液体挥发
将锥形瓶放入冰水中冷却
将锥形瓶放入冰水中冷却
(5)画出虚线框内与F连接的仪器,并指出其中盛装试剂名称,以完善该实验装置.
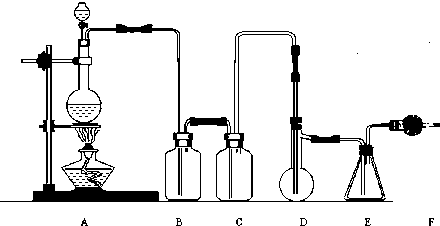
分析:(1)用固液加热的方法制Cl2,常用浓盐酸和二氧化锰反应制取;
(2)用浓硫酸进行干燥即可得纯净干燥的氯气;二氯化硫遇水易分解,要隔绝空气中水的干扰;
(3)防止空气中的氧气与硫粉反应;增大反应接触面积能加快反应速率;
(4)二氯化硫(SCl2)熔点-78℃,沸点59℃;
(5)缺少尾气吸收装置.
(2)用浓硫酸进行干燥即可得纯净干燥的氯气;二氯化硫遇水易分解,要隔绝空气中水的干扰;
(3)防止空气中的氧气与硫粉反应;增大反应接触面积能加快反应速率;
(4)二氯化硫(SCl2)熔点-78℃,沸点59℃;
(5)缺少尾气吸收装置.
解答:解:(1)用固液加热的方法制Cl2,常用浓盐酸和二氧化锰反应制取,反应离子方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)用浓硫酸进行干燥即可得纯净干燥的氯气;二氯化硫遇水易分解,要用吸水剂隔绝空气中水的干扰,故答案为:浓硫酸;防水从后面进入E使二氯化硫分解;
(3)防止空气中的氧气可与硫粉反应;由粉末状变为一薄层,增大了反应接触面积,能加快反应速率,使反应充分,故答案为:防止加热硫粉时,空气中的氧气与硫粉反应; 增大接触面积以加快反应速率;
(4)二氯化硫(SCl2)熔点-78℃,可以将锥形瓶放入冰水中冷却,防止E中液体二氯化硫(SCl2)挥发,故答案为:将锥形瓶放入冰水中冷却;
(5)用 吸收残留余的氯气,故答案为:
吸收残留余的氯气,故答案为: (加有安全瓶等不扣分);
(加有安全瓶等不扣分);
| ||
故答案为:MnO2+4HCl(浓)
| ||
(2)用浓硫酸进行干燥即可得纯净干燥的氯气;二氯化硫遇水易分解,要用吸水剂隔绝空气中水的干扰,故答案为:浓硫酸;防水从后面进入E使二氯化硫分解;
(3)防止空气中的氧气可与硫粉反应;由粉末状变为一薄层,增大了反应接触面积,能加快反应速率,使反应充分,故答案为:防止加热硫粉时,空气中的氧气与硫粉反应; 增大接触面积以加快反应速率;
(4)二氯化硫(SCl2)熔点-78℃,可以将锥形瓶放入冰水中冷却,防止E中液体二氯化硫(SCl2)挥发,故答案为:将锥形瓶放入冰水中冷却;
(5)用
 吸收残留余的氯气,故答案为:
吸收残留余的氯气,故答案为: (加有安全瓶等不扣分);
(加有安全瓶等不扣分);点评:本题考查的知识面较广,思考空间较大,综合性较强,有一定的难度.

练习册系列答案
相关题目