题目内容
(I)下列有关实验的叙述中,合理的是
A.把SO2通入紫色石蕊试液,可验证SO2的漂白性
B.一学生用pH试纸测得某氯水的pH为2
C.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
D.将10g ZnSO4?7H2O溶解在90g水中配制10%的ZnSO4溶液
E.向某溶液中滴加氯化钡溶液,产生不溶于稀硝酸的白色沉淀,则该溶液中一定含有SO2-4
F.配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液浓度偏高
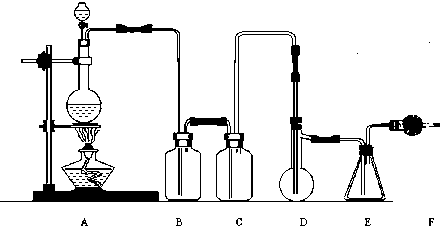
(II)(二氯化硫(SCl2)熔点-78℃,沸点59℃.密度1.638g/mL.遇水易分解二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2).以下是由氯气与硫反应合成二氯化硫的实验装置.

回答下列问题:
(1)装置B盛放的药品是
(2)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁表面形成一薄层,这样做的目的是
(3)实验时,D装置需加热至50-59℃,最好采用何种方式加热
(4)F装置中干燥管内所盛物质是
CF
CF
(填序号)A.把SO2通入紫色石蕊试液,可验证SO2的漂白性
B.一学生用pH试纸测得某氯水的pH为2
C.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
D.将10g ZnSO4?7H2O溶解在90g水中配制10%的ZnSO4溶液
E.向某溶液中滴加氯化钡溶液,产生不溶于稀硝酸的白色沉淀,则该溶液中一定含有SO2-4
F.配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液浓度偏高
(II)(二氯化硫(SCl2)熔点-78℃,沸点59℃.密度1.638g/mL.遇水易分解二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2).以下是由氯气与硫反应合成二氯化硫的实验装置.

回答下列问题:
(1)装置B盛放的药品是
饱和食盐水
饱和食盐水
C中是浓硫酸
浓硫酸
(2)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁表面形成一薄层,这样做的目的是
增大反应接触面积
增大反应接触面积
(3)实验时,D装置需加热至50-59℃,最好采用何种方式加热
水浴加热
水浴加热
.为了防止E中液体挥发,可以采取的措施将锥形瓶放入冰水中冷却
将锥形瓶放入冰水中冷却
.(4)F装置中干燥管内所盛物质是
碱石灰(或固体氢氧化钠或生石灰)
碱石灰(或固体氢氧化钠或生石灰)
的作用是:防止空气中水蒸气进入并吸收残留余的氯气
防止空气中水蒸气进入并吸收残留余的氯气
.分析:(I)A.SO2具有漂白性,能使品红褪色;
B.氯水为氯气的水溶液,显酸性,其中的次氯酸有漂白性;
C.氢氧化钠或碳酸钠和二氧化硅能反应;
D.w%=
×100%;
E.不溶于稀硝酸的白色沉淀有氯化银和硫酸钡两种;
F.配制一定物质的量浓度的溶液,定容读数时:俯高仰低.
(II)(1)制得的氯气不纯,混有氯化氢和水,应除去;
(2)增大反应接触面积能加快反应速率;
(3)需加热至0-100℃,最好采用水浴加热的方式;
(4)二氯化硫遇水易分解,要隔绝空气中水的干扰.
B.氯水为氯气的水溶液,显酸性,其中的次氯酸有漂白性;
C.氢氧化钠或碳酸钠和二氧化硅能反应;
D.w%=
| 溶质的质量 |
| 溶液的质量 |
E.不溶于稀硝酸的白色沉淀有氯化银和硫酸钡两种;
F.配制一定物质的量浓度的溶液,定容读数时:俯高仰低.
(II)(1)制得的氯气不纯,混有氯化氢和水,应除去;
(2)增大反应接触面积能加快反应速率;
(3)需加热至0-100℃,最好采用水浴加热的方式;
(4)二氯化硫遇水易分解,要隔绝空气中水的干扰.
解答:解:(I)A.SO2具有漂白性和酸性即还原性等,能使品红褪色,把SO2通入紫色石蕊试液中,会变红色,故A错误;
B.氯水为氯气的水溶液,显酸性,其中的次氯酸有漂白性,不能用pH试纸测,故B错误;
C.氢氧化钠或碳酸钠和二氧化硅能反应,不宜用瓷坩埚灼烧氢氧化钠或碳酸钠,故C正确;
D.w%=
×100%,溶液的质量为100g,而溶质ZnSO4的质量小于10g,故D错误;
E.向某溶液中滴加氯化钡溶液,产生不溶于稀硝酸的白色沉淀,则该溶液中可能含有硫酸根或银离子中的至少一种,故E错误;
F.配制一定物质的量浓度的溶液,定容读数时:俯视导致结果偏高,仰视导致结果偏低,故F正确.
故答案为:CF;
(II)(1)制得的氯气不纯,混有氯化氢和水,除去氯化氢用饱和食盐水,除水用浓硫酸,故答案为:饱和食盐水;浓硫酸;
(2)由粉末状变为一薄层,增大了反应接触面积,能加快反应速率,使反应充分,故答案为:增大反应接触面积;
(3)需加热至0-100℃,最好采用水浴加热的方式,二氯化硫(SCl2)熔点-78℃,可以将锥形瓶放入冰水中冷却,防止E中液体二氯化硫(SCl2)挥发,故答案为:水浴加热;将锥形瓶放入冰水中冷却;
(4)二氯化硫遇水易分解,要用吸水剂隔绝空气中水的干扰,故答案为:碱石灰(或固体氢氧化钠或生石灰);防止空气中水蒸气进入并吸收残留余的氯气.
B.氯水为氯气的水溶液,显酸性,其中的次氯酸有漂白性,不能用pH试纸测,故B错误;
C.氢氧化钠或碳酸钠和二氧化硅能反应,不宜用瓷坩埚灼烧氢氧化钠或碳酸钠,故C正确;
D.w%=
| 溶质的质量 |
| 溶液的质量 |
E.向某溶液中滴加氯化钡溶液,产生不溶于稀硝酸的白色沉淀,则该溶液中可能含有硫酸根或银离子中的至少一种,故E错误;
F.配制一定物质的量浓度的溶液,定容读数时:俯视导致结果偏高,仰视导致结果偏低,故F正确.
故答案为:CF;
(II)(1)制得的氯气不纯,混有氯化氢和水,除去氯化氢用饱和食盐水,除水用浓硫酸,故答案为:饱和食盐水;浓硫酸;
(2)由粉末状变为一薄层,增大了反应接触面积,能加快反应速率,使反应充分,故答案为:增大反应接触面积;
(3)需加热至0-100℃,最好采用水浴加热的方式,二氯化硫(SCl2)熔点-78℃,可以将锥形瓶放入冰水中冷却,防止E中液体二氯化硫(SCl2)挥发,故答案为:水浴加热;将锥形瓶放入冰水中冷却;
(4)二氯化硫遇水易分解,要用吸水剂隔绝空气中水的干扰,故答案为:碱石灰(或固体氢氧化钠或生石灰);防止空气中水蒸气进入并吸收残留余的氯气.
点评:本题考查的知识面较广,思考空间较大,综合性较强,有一定的难度.

练习册系列答案
相关题目
(I)(4分)下列有关实验的叙述中,合理的是 (填序号)
A.把SO2通入紫色石蕊试液,可验证SO2的漂白性
B.一学生用pH试纸测得某氯水的pH为2
C.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
D.将10g ZnSO4?7H2O溶解在90g水中配制10%的ZnSO4溶液
E.向某溶液中滴加氯化钡溶液,产生不溶于稀硝酸的白色沉淀,则该溶液中一定
含有SO2-4
F.配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液浓度偏高
|
回答下列问题:
(1)装置B盛放的药品是 C中是
(2)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁表面形成一薄层,这样做的目的是
(3)实验时,D装置需加热至50―59℃,最好采用何种方式加热 。为了防止E中液体挥发,可以采取的措施 。
(4)F装置中干燥管内所盛物质是 的作用是: