题目内容
 短周期元素E、F的离子F+与E2-核外电子排布相同,B、D、E元素的原子序数依次递增,B原子的每个能级上电子数相等,BE2和D2E是等电子体、A是F所在周期非金属性最强的元素,G.E同主族且原子核外电子层数相差两层,
短周期元素E、F的离子F+与E2-核外电子排布相同,B、D、E元素的原子序数依次递增,B原子的每个能级上电子数相等,BE2和D2E是等电子体、A是F所在周期非金属性最强的元素,G.E同主族且原子核外电子层数相差两层,请回答以下问题:
(1)元素F周期表中的位置在
(2)AE-3中的中心原子的杂化类型
(3)D2与B2-2是等电子体,写出化合物CaB2的电子式
(4)比较E、G组成的最低价氢化物(填化学式):
①稳定的是
(5)BE2的分子构型为
分析:短周期元素E、F的离子F+与E2-核外电子排布相同,可推知F为Na、E为O元素;B、D、E元素的原子序数依次递增,B原子的每个能级上电子数相等,则其原子核外电子排布为1s22s22p2,则B为碳元素;CO2和D2O是等电子体,则D为N元素;A是F(Na元素)所在周期非金属性最强的元素,则A为Cl;G、E同主族且原子核外电子层数相差两层,则G为Se,据此计算.
解答:解:短周期元素E、F的离子F+与E2-核外电子排布相同,可推知F为Na、E为O元素;B、D、E元素的原子序数依次递增,B原子的每个能级上电子数相等,则其原子核外电子排布为1s22s22p2,则B为碳元素;CO2和D2O是等电子体,则D为N元素;A是F(Na元素)所在周期非金属性最强的元素,则A为Cl;G、E同主族且原子核外电子层数相差两层,则G为Se,
(1)元素F为Na,在周期表中的位置为第三周期第ⅠA族;电子层结构相同,核电荷数越大离子半径越小,故离子半径Na+<O2-,
故答案为:第三周期第ⅠA族;<;
(2)ClO-3中的中心Cl原子价层电子对数=3+
=4,Cl原子采取sp3杂化,由于Cl原子有1对孤对电子,故该离子为三角锥形构型,
故答案为:sp3;三角锥形;
(3)N2与C2-2是等电子体,二者结构相似,化合物CaC2的电子式为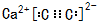 ;Se处于第四周期ⅥA族,其原子基态价层电子排布式为4s24p4,
;Se处于第四周期ⅥA族,其原子基态价层电子排布式为4s24p4,
故答案为: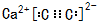 ;4s24p4;
;4s24p4;
(4)O、As组成的最低价氢化物分别为H2O、H2Se:
①非金属性O>Se,故稳定性H2O>H2Se;②非金属性越强、阴离子还原性越弱,故还原性强的是H2O<H2Se;③H2O分子之间存在氢键,氢键比范德华力更强,故沸点H2O>H2Se,
故答案为:H2O;H2Se;H2O;
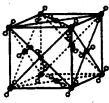
(5)CO2的分子构型为直线型,其晶体属于分子晶体,该晶胞中微粒间的作用力为范德华力,以顶点CO2分子为研究对象,与之最近CO2分子位于面心上,一个CO2分子为12个面共用,故一个CO2分子周围最近的CO2分子有12个,由图可知,晶胞中CO2分子数目=8×
+6×
=4,故晶胞质量=4×
g,若该晶体的密度是dg/cm3,则晶胞的边长=
=
cm,
故答案为:直线型;范德华力;12;
.
(1)元素F为Na,在周期表中的位置为第三周期第ⅠA族;电子层结构相同,核电荷数越大离子半径越小,故离子半径Na+<O2-,
故答案为:第三周期第ⅠA族;<;
(2)ClO-3中的中心Cl原子价层电子对数=3+
| 7+1-2×3 |
| 2 |
故答案为:sp3;三角锥形;
(3)N2与C2-2是等电子体,二者结构相似,化合物CaC2的电子式为
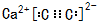 ;Se处于第四周期ⅥA族,其原子基态价层电子排布式为4s24p4,
;Se处于第四周期ⅥA族,其原子基态价层电子排布式为4s24p4,故答案为:
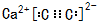 ;4s24p4;
;4s24p4;(4)O、As组成的最低价氢化物分别为H2O、H2Se:
①非金属性O>Se,故稳定性H2O>H2Se;②非金属性越强、阴离子还原性越弱,故还原性强的是H2O<H2Se;③H2O分子之间存在氢键,氢键比范德华力更强,故沸点H2O>H2Se,
故答案为:H2O;H2Se;H2O;
(5)CO2的分子构型为直线型,其晶体属于分子晶体,该晶胞中微粒间的作用力为范德华力,以顶点CO2分子为研究对象,与之最近CO2分子位于面心上,一个CO2分子为12个面共用,故一个CO2分子周围最近的CO2分子有12个,由图可知,晶胞中CO2分子数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 44 |
| NA |
| 3 |
| ||||
| 3 |
| ||
故答案为:直线型;范德华力;12;
| 3 |
| ||
点评:本题考查物质结构域性质,涉及元素推断、半径比较、分子结构与性质、核外电子排布、晶胞结构与计算等,(5)中注意利用补全晶胞理解,利用均摊法计算晶胞的质量是关键.

练习册系列答案
相关题目