题目内容
下列各种溶液粒子物质的量浓度关系正确的是()
A.0.1mol·V的NH4Cl溶液与0.05mol·L-1的NaOH溶液等体积混合:c(Cl-)>c(Na+)>c( )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
B.0.2mol·L-1Na2CO3溶液:c(OH-)=c( )+c(H+)+2c(H2CO3) )+c(H+)+2c(H2CO3) |
C.0.2mol·L-1(NH4)2SO4溶液:c( )>c( )>c( )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
D.0.2mol·L-1NaHCO3溶液:c(Na+)>c( )>c( )>c( )>c(OH-) )>c(OH-) |
B
选项A
NH4Cl+NaOH====NaCl+NH3·H2O
0.050.050.050.05
溶液的酸碱性取决于NH4Cl和NH3·H2O,其可能性有三种:NH4Cl水解程度>NH3·H2O电离程度,呈酸性;反之,呈碱性;相当,则呈中性。故无法选择。
选项B有两种解法:
方法一:电荷守恒+物料守恒
c(Na+)+c(H+)=c( )×2+c(
)×2+c(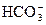 )×1+c(OH-)①
)×1+c(OH-)①
c(Na+)=2c( )+c(
)+c(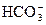 )+c(H2CO3)②
)+c(H2CO3)②
②-①整理得:c(OH-)=c(H+)+c(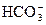 )+?2c(H2CO3)
)+?2c(H2CO3)
方法二:质子在H2O与 之间传递
之间传递

因左右两边的质子数守恒,且等量代换,
故:c(OH-)=c(H+)+c(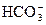 )+2c(H2CO3)。
)+2c(H2CO3)。
选项C,一定是c( )>c(
)>c( )。
)。
选项D,一定是c(OH-)>c( ),因
),因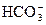 的电离程度<水解的程度。
的电离程度<水解的程度。
NH4Cl+NaOH====NaCl+NH3·H2O
0.050.050.050.05
溶液的酸碱性取决于NH4Cl和NH3·H2O,其可能性有三种:NH4Cl水解程度>NH3·H2O电离程度,呈酸性;反之,呈碱性;相当,则呈中性。故无法选择。
选项B有两种解法:
方法一:电荷守恒+物料守恒
c(Na+)+c(H+)=c(
 )×2+c(
)×2+c(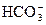 )×1+c(OH-)①
)×1+c(OH-)①c(Na+)=2c(
 )+c(
)+c(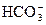 )+c(H2CO3)②
)+c(H2CO3)②②-①整理得:c(OH-)=c(H+)+c(
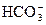 )+?2c(H2CO3)
)+?2c(H2CO3)方法二:质子在H2O与
 之间传递
之间传递
因左右两边的质子数守恒,且等量代换,
故:c(OH-)=c(H+)+c(
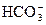 )+2c(H2CO3)。
)+2c(H2CO3)。选项C,一定是c(
 )>c(
)>c( )。
)。选项D,一定是c(OH-)>c(
 ),因
),因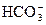 的电离程度<水解的程度。
的电离程度<水解的程度。
练习册系列答案
相关题目
 溶液中
溶液中
 溶液中:
溶液中:
 溶液中:
溶液中:
 溶液中:
溶液中:
 与CO2含相等电子数
与CO2含相等电子数 )=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(
)=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c( )=_________。
)=_________。