题目内容
13.MnO2是一种重要的无机功能材料.某研究性学习小组设计了将粗MnO2 (含有较多的MnO和MnCO3)样品转化为纯净MnO2的实验,其流程如图: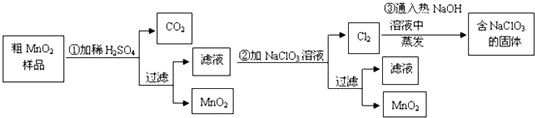
请回答下列问题:
(1)第①步加硫酸时,粗MnO2样品中的MnO和MnCO3转化为(填化学式)MnSO4.
(2)第①步反应中的硫酸能否用盐酸代替?否(填“能”或“否”),理由是盐酸能被二氧化锰氧化成氯气.
(3)第②步发生反应的离子方程式为5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+.
(4)取17.4g MnO2与200g 36.5%的浓盐酸(足量)反应,将反应后剩余的溶液用水稀释至500mL,稀释后溶液中Cl-的物质的量浓度为3.2mol/L.
分析 由制备流程可知,MnO2不溶于硫酸,样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,滤液中含MnSO4,第②步发生5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,第③步中发生氯气与热的NaOH发生氧化还原反应生成NaCl、NaClO3、水,溶液蒸发可得到固体,
(1)MnO2不溶于硫酸,样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4;
(2)盐酸可以被二氧化锰氧化成氯气,据此答题;
(3)依据得失电子守恒和质量守恒可写出离子方程式;
(4)根据反应方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,可计算反应中消耗的氯离子,再根据c=$\frac{n}{V}$计算浓度;
解答 解:由制备流程可知,MnO2不溶于硫酸,样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,滤液中含MnSO4,第②步发生5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,第③步中发生氯气与热的NaOH发生氧化还原反应生成NaCl、NaClO3、水,溶液蒸发可得到固体,
(1)MnO2不溶于硫酸,所以加稀硫酸时样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,所以粗MnO2样品中的MnO和MnCO3转化为可溶性物质,
故答案为:MnSO4;
(2)盐酸可以被二氧化锰氧化成氯气,所以不能用盐酸代替硫酸,
故答案为:否;盐酸能被二氧化锰氧化成氯气;
(3)MnSO4要转化为MnO2,需失去电子,故需要加入NaClO3做氧化剂,依据得失电子守恒可以配平,所以反应的化学方程式是:5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,因此反应的离子方程式是:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,
故答案为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+;
(4)17.4g MnO2的物质的量为0.2mol,根据方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,0.2molMnO2能消耗Cl-0.4mol,所以溶液中剩余的Cl-的物质的量为=$\frac{200×36.5%}{36.5}$mol-0.4mol=1.6mol,所以稀释后溶液中Cl-的物质的量浓度为$\frac{1.6mol}{0.5L}$=3.2mol/L,
故答案为:3.2mol/L.
点评 本题考查混合物分离、提纯的实验方案的设计,为高频考点,把握流程中发生的化学反应及混合物分离方法为解答的关键,侧重分析能力及推断能力的考查,题目难度不大.

| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(金刚石,s)=C(石墨,s)△H=-1.90 kJ/mol可知,金刚石比石墨稳定 | |
| C. | 氢气的燃烧热285.8kJ/mol,氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(l)△H=+285.8 kJ/mol | |
| D. | 氢氧化钡晶体与氯化铵晶体混合吸热,反应物的总键能之和高于生成物的总键能之和 |
| A. | KCl | B. | CaCl2 | C. | BaCl2 | D. | AlCl3 |
| A. |  如图表示ⅥA族元素的氢化物的沸点 | |
| B. |  如图表示ⅦA族元素的熔点 | |
| C. |  如图表示Na+、Mg2+、Al3+的半径 | |
| D. |  如图表示第三周期元素的单质的熔点 |
| A. | 铁与硫 | B. | 碳与氧气 | ||
| C. | 二氧化硫和氢氧化钠溶液 | D. | 氯化铝溶液和氢氧化钠溶液 |
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mol (CH2)6N4H+与 l mol H+相当,然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g.
步骤II 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤III 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤III 填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察B
(A)滴定管内液面的变化 (B)锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成粉红(或浅红)色.
(2)滴定结果如表所示:
| 滴定 次数 | 待测溶液的体积 /mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
| A. | 1mol H2O的质量为18g/mol | |
| B. | 常温常压下,0.05NA个CO2分子所占的体积是1.12L | |
| C. | 3.01×1023个SO2分子的质量为32g | |
| D. | 标准状况下2gO2与3gO3所含原子个数相等 |
| A. | 铁质菜刀生锈 | B. | 燃放烟花爆竹 | C. | 食物腐败变质 | D. | 煅烧石灰石 |