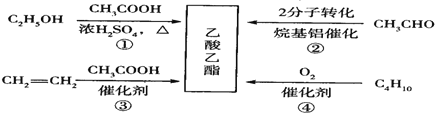
题目内容
【题目】下表列出了a~z15种元素在周期表中的位置:
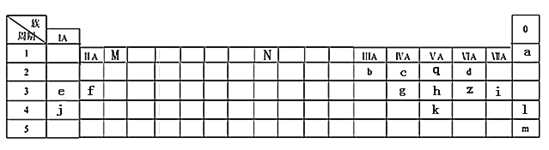
(1)元素b为___________(填名称);画出g的原子结构示意图_____________。
(2)写出M、N分别表示的族序数为_________、___________。元素f、i、j的原子分别形成简单离子后,离子半径从大到小的顺序是_______________(用离子符号表示)。元素l、m原子序数之差为_____。
(3)元素d和e形成的一种化合物为淡黄色固体,该化合物的电子式为_____________,该化合物中化学键有__________,该化合物可与z的一种氧化物发生化合反应,写出该反应的化学方程式为______________________________________________。
(4)根据元素周期表推测k元素及其化合物的性质正确的是_________
A.气态氢化物的稳定性:k>h>q B.k所在的主族元素通常用于制造农药和半导体材料
C.k的最高正价为+6 D.氢化物的沸点:q>k
(5)f与q形成的离子化合物可以与d的氢化物发生反应,写出该反应的化学方程式为_______________。
【答案】硼  ⅢB Ⅷ Cl->K+>Mg2+ 18
ⅢB Ⅷ Cl->K+>Mg2+ 18  离子键、(非极性)共价键 Na2O2+SO2=Na2SO4 D Mg3N2+6H2O=3Mg(OH)2+2NH3↑
离子键、(非极性)共价键 Na2O2+SO2=Na2SO4 D Mg3N2+6H2O=3Mg(OH)2+2NH3↑
【解析】
根据元素在周期表中的位置判断元素的种类,根据元素周期律及元素性质分析解答。
(1)元素b为硼;g是Si,原子序数是14,原子结构示意图为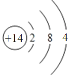 ,故答案为:硼;
,故答案为:硼; ;
;
(2)如图所示,M在ⅢB 族,N在Ⅷ族;同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则元素f、i、j的原子半径从大到小的顺序是K>Mg>Cl;核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则这三种原子分别形成简单离子后,离子半径从大到小的顺序是Cl->K+>Mg2+,故答案为:ⅢB; Ⅷ; Cl->K+>Mg2+
(3)元素O和Na形成的一种化合物为淡黄色固体,为过氧化钠,过氧化钠的电子式为 ,其中化学键有离子键、(非极性)共价键,该化合物与SO2反应的化学方程式为Na2O2+SO2=Na2SO4,故答案为:
,其中化学键有离子键、(非极性)共价键,该化合物与SO2反应的化学方程式为Na2O2+SO2=Na2SO4,故答案为:  ; 离子键、(非极性)共价键;Na2O2+SO2=Na2SO4;
; 离子键、(非极性)共价键;Na2O2+SO2=Na2SO4;
(4)A.同主族从上到下非金属性逐渐减弱,氢化物的稳定性逐渐减弱,则气态氢化物的稳定性:k<h<q,A错误;
B.k所在的主族即第ⅤA元素通常用于制造农药,但一般不能制作半导体材料,B错误;
C.As的最高正价为+5价,C错误;
D.氨气分子间存在氢键,则As的氢化物的沸点比NH3低,D正确;故答案为:D。
(5)氮化镁与水反应生成氢氧化镁和氨气,反应方程式为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,故答案为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D