题目内容
由于金属钠很容易与空气中的 、 等物质反应,少量的钠通常将它保存在 里;在实验室里做钠跟水反应的实验时,用到的仪器是 。(填序号)
a.试管夹 b.镊子 c.小刀 d.冷凝管 e.滤纸 f.研钵 g.烧杯 h.坩埚 i.石棉网
j.玻璃片 k.药匙 l.燃烧匙
a.试管夹 b.镊子 c.小刀 d.冷凝管 e.滤纸 f.研钵 g.烧杯 h.坩埚 i.石棉网
j.玻璃片 k.药匙 l.燃烧匙
氧气、水,煤油 bcej 。
试题分析:Na很活泼,很容易与空气中的O2、H2O发生化学反应:4Na+ O2=2Na2O,2Na+2H2O=2NaOH+H2↑.所以Na保存时要隔绝空气和水。由于煤油的密度比Na小,所以少量的钠通常将它保存在煤油中。在实验室里做钠跟水反应的实验时,要用镊子来夹取,然后用滤纸吸干表面的煤油,放在玻璃片上用小刀来切去绿豆粒大小的金属Na来进行实验。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
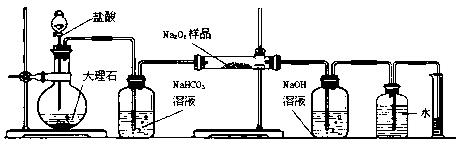
 测定剩余固体质量
测定剩余固体质量 测定沉淀质量
测定沉淀质量 测定生成二氧化碳的质量
测定生成二氧化碳的质量