题目内容
6.有A、B、C、D 4种短周期元素,它们的核电荷数依次增大.在元素周期表中,A原子半径最小,A与C是同主族元素,B与D也是同主族元素,B、D两元素的原子序数之和是A、C两元素的原子序数之和的两倍,D元素的单质是淡黄色固体.(1)B、C、D原子半径由大到小的顺序为Na>S>O.(填元素符号)
(2)写出化合物A2B电子式:
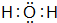 .
.(3)电子式表示化合物 C2D 的形成过程:
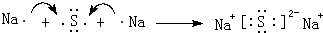 .
.(4)元素周期表位于对角线的两种元素其性质相似称之为对角线规则.根据周期表对角线规律,金属Be单质及其化合物的性质与铝单质及其化合物的性质相似.
①写出Be与C的最高价氧化物对应的水化物溶液反应的化学方程式Be+2NaOH═Na2BeO2+H2↑.
②鉴别Be(OH)2和Mg(OH)2可选用的试剂为NaOH溶液.
分析 有A、B、C、D 4种短周期元素,它们的核电荷数依次增大.在元素周期表中,A原子半径最小,则A为H元素;A与C是同主族元素,原子序数相差大于2,故C为Na;B与D也是同主族元素,B、D两元素的原子序数之和是A、C两元素的原子序数之和的两倍,D元素的单质是淡黄色固体,可推知B为O元素、D为S元素.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)化合物H2O中氧原子与氢原子之间形成1对共用电子对;
(3)化合物 Na2S由钠离子与硫离子构成,用钠原子、硫原子电子式表示其形成过程;
(4)①Be与Al的性质相似,则Be与NaOH溶液反应生成Na2BeO2与H2;
②Be和Al位于对角线位置,性质相似,Be(OH)2与NaOH反应,而Mg(OH)2不能,则鉴别二者的试剂为NaOH溶液.
解答 解:有A、B、C、D 4种短周期元素,它们的核电荷数依次增大.在元素周期表中,A原子半径最小,则A为H元素;A与C是同主族元素,原子序数相差大于2,故C为Na;B与D也是同主族元素,B、D两元素的原子序数之和是A、C两元素的原子序数之和的两倍,D元素的单质是淡黄色固体,可推知B为O元素、D为S元素.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>S>O,故答案为:Na>S>O;
(2)化合物H2O电子式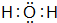 ,故答案为:
,故答案为: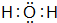 ;
;
(3)用电子式表示化合物 Na2S 的形成过程: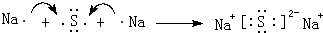 ,
,
故答案为: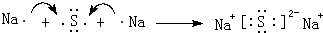 ;
;
(4)①Be与Al的性质相似,则Be与NaOH溶液反应方程式为:Be+2NaOH═Na2BeO2+H2↑,故答案为:Be+2NaOH═Na2BeO2+H2↑;
②Be(OH)2与NaOH反应,而Mg(OH)2不能,则鉴别二者的试剂为NaOH溶液,故答案为:NaOH溶液.
点评 本题考查结构性质位置关系应用,(4)注意利用已有知识进行类比解答,难度中等.

| A. | 氧气和臭氧 | B. | 乙烷和乙烯 | ||
| C. | 氕、氘和氚 | D. | 正戊烷、异戊烷和新戊烷 |
| X | Y | |
| Z | W |
(1)元素Z位于周期表中的位置第三周期VA族;
(2)这些元素的氢化物中,水溶液碱性最强的是NH3(写化学式);
(3)XW2的电子式为
 ;
;(4)Y的最高价氧化物的化学式为N2O5;
(5)W和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且W的质量分数约为70%.该化合物的化学式为S4N4.
| A. | 9a/b mol-1 | B. | 9b/a 1mol-1 | C. | b/a mol-1 | D. | a/bmol- |
| A. | 反应前两种酸的物质的量浓度不同 | |
| B. | 反应开始后,盐酸的H+浓度减小快 | |
| C. | 反应开始后,两种酸产生的氢气量相同 | |
| D. | 从反应开始到结束,醋酸所用的时间较少 |