题目内容
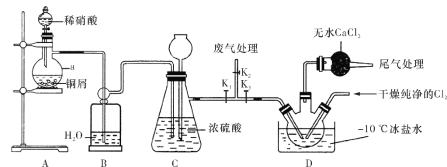
【题目】亚硝酰氯(ClNO)常用作催化剂和合成洗涤剂,其沸点为-5.5 ℃,易水解。某学习小组在实验室中用下图所示装置制备ClNO。已知:HNO2既有氧化性又有还原性;AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3===AgNO3+HNO2。
请回答下列问题:
(1)仪器a的名称为________,装置B的作用是________。
(2)装置A中发生反应的化学方程式为________。
(3)装置C中长颈漏斗的作用是________。
(4)实验开始时,先打开K1、K2,关闭K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到装置C中________时关闭K1、K2。向装置D三颈瓶中通入干燥纯净的Cl2,当瓶中充满黄绿色气体时,再打开K1、K3,制备ClNO。
(5)装置D中干燥管的作用是________。
(6)ClNO与H2O反应生成HNO2和HCl。
①设计实验证明HNO2是弱酸:________(仅提供的试剂:1 mol·L-1盐酸、1 mol·L-1 HNO2溶液、NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②要验证ClNO与 H2O 反应后的溶液中存在Cl-和HNO2,合理的操作步骤及正确的顺序是________(填字母代号)。
a.向烧杯中滴加过量KI淀粉溶液,溶液变蓝色
b.取1.0 mL ClNO加入到盛有10.0 mL H2O的烧杯中,充分反应
c.向烧杯中滴加酸性KMnO4溶液,溶液紫红色褪去
d.向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,加入稀硝酸,搅拌,仍有白色沉淀
【答案】蒸馏烧瓶 除去NO中的HNO3、NO2气体 3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O 平衡气压,避免装置C中压强过大 红棕色完全消失 防止水蒸气进入三颈瓶中与ClNO反应 用玻璃棒蘸取NaNO2溶液,点在红色石蕊试纸上,试纸变蓝,说明HNO2是弱酸 bdc
【解析】
(1)仪器a为蒸馏烧瓶,B的作用是除去NO中的HNO3、NO2气体等杂质;
(2)Cu与稀硝酸发生反应生成硝酸铜、一氧化氮和水;
(3)长颈漏斗的作用是平衡气压,避免装置C中压强过大;
(4)当C中红棕色完全消失时,不再存在NO2气体;
(5)D中干燥管的作用是防止水蒸气进入三颈瓶中与ClNO反应;
(6)①用玻璃棒蘸取NaNO2溶液点在红色石蕊试纸上,若试纸变蓝,则说明HNO2是弱酸;
②首先要使ClNO与水反应;因为碘化银为沉淀,而酸性高锰酸钾能将氯离子氧化,所以需要先验证氯离子的存在;由于引入了足量的银离子,所以仅能使用酸性高锰酸钾验证亚硝酸。
(1)仪器a为蒸馏烧瓶,NO不溶于水,而可能存在的杂质HNO3、NO2均易溶于水,所以B的作用是除去NO中的HNO3、NO2气体等杂质,故答案为:蒸馏烧瓶,除去NO中的HNO3、NO2气体。
(2)装置A中Cu与稀硝酸发生反应生成硝酸铜、一氧化氮和水,化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,故答案为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(3)若关闭K1,随着反应的进行,C中压强逐渐,长颈漏斗的作用是平衡气压,避免装置C中压强过大,故答案为:平衡气压,避免装置C中压强过大。
(4)为了得到比较纯净的NO,当C中红棕色完全消失时,不再存在NO2气体,故答案为:红棕色完全消失。
(5)因为亚硝酰氯(ClNO)易于水反应水解,所以必须防止有水蒸气进入三颈烧瓶中与ClNO反应,所以D中干燥管的作用是防止水蒸气进入三颈瓶中与ClNO反应,故答案为:防止水蒸气进入三颈瓶中与ClNO反应。
(6)①若亚硝酸为弱酸,则亚硝酸盐水解呈弱碱性,即用玻璃棒蘸取NaNO2溶液点在红色石蕊试纸上,若试纸变蓝,则说明HNO2是弱酸,故答案为:使用玻璃棒蘸取NaNO2溶液点在红色石蕊试纸上,若试纸变蓝,则说明HNO2是弱酸。
②首先要使ClNO与水反应,选择b;因为碘化银为沉淀,而酸性高锰酸钾能将氯离子氧化,所以需要先验证氯离子的存在,选择d;由于引入了足量的银离子,所以仅能使用酸性高锰酸钾验证亚硝酸,选择c;所以正确的顺序是bdc,故答案为:bdc。

【题目】有Ⅰ、Ⅱ、Ⅲ3个体积均为0.5L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)△H。HCl的平衡转化率与Z和T的关系如图所示。
2Cl2(g)+2H2O(g)△H。HCl的平衡转化率与Z和T的关系如图所示。
容器 | 起始时 | ||
T/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |

下列说法不正确的是( )
A. △H<0
B. a<4<b
C. 若容器Ⅲ反应某时刻处于R点,则R点的反应速率:v(正)>v(逆)
D. 300℃时,该反应平衡常数的值为320




