题目内容
【题目】已知铁生锈的过程为:Fe → Fe(OH)2 → Fe(OH)3 → Fe2O3·xH2O。又知草酸(H2C2O4)分解产生CO等气体某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
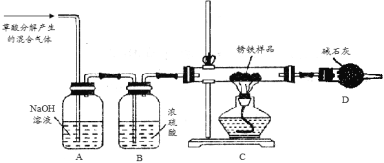
(1)甲同学利用草酸分解产生的混合气体和下图所示装置测定其中一种锈铁的组成。
主要操作为:取锈铁样品12.6 g置于装置C的硬质玻璃管中,加热完全反应后得到固体的质量为8.4 g,装置D增重8.4 g。
草酸(H2C2O4)分解的化学方程式为 。
(2)乙同学在甲同学装置的基础上将装置D换成装浓硫酸的洗气瓶(装置E,此装置图略),经改进后,重新按甲同学的操作和样品取用量进行实验,若完全反应后得到固体的质量仍为8.4 g,而装置E增重1.8 g,则x = ;m(Fe):m (Fe2O3·xH2O) =
【答案】(1)H2C2O4![]() CO↑ + CO2↑ + H2O (2) 2 2:7
CO↑ + CO2↑ + H2O (2) 2 2:7
【解析】
试题分析:(1)从图分析,草酸分解后通过氢氧化钠溶液,说明产生了二氧化碳气体,用氢氧化钠吸收,所以草酸分解生成二氧化碳和一氧化碳和水,方程式为:H2C2O4![]() CO↑ + CO2↑ + H2O。(2) 甲同学实验中装置D原来增重为吸收的水和二氧化碳的质量,为8.4克,乙同学实验中E增重为水的质量为1.8克,则说明反应产生的二氧化碳的质量为8.4-1.8=6.6克,根据方程式3CO+Fe2O3·xH2O =3CO2+2Fe +xH2O分析,则有3:x=6.6/44:1.8/18,解x=2,有112:44×3=y:6.6,解y=5.6g,则原来的铁的质量为8.4-5.6=2.8克,氧化物的质量为12.6-2.8=9.8克,则m(Fe):m (Fe2O3·xH2O) =2.8:9.8=2:7。
CO↑ + CO2↑ + H2O。(2) 甲同学实验中装置D原来增重为吸收的水和二氧化碳的质量,为8.4克,乙同学实验中E增重为水的质量为1.8克,则说明反应产生的二氧化碳的质量为8.4-1.8=6.6克,根据方程式3CO+Fe2O3·xH2O =3CO2+2Fe +xH2O分析,则有3:x=6.6/44:1.8/18,解x=2,有112:44×3=y:6.6,解y=5.6g,则原来的铁的质量为8.4-5.6=2.8克,氧化物的质量为12.6-2.8=9.8克,则m(Fe):m (Fe2O3·xH2O) =2.8:9.8=2:7。