题目内容
火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H1=-574 kJ·mol-1 ①
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H2=-1160 kJ·mol-1 ②
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3


①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。回答:0~10 min内,氢气的平均反应速率为 mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 (填“正向”、“逆向”或“不”)移动。
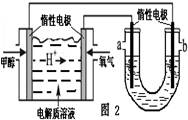
②如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解300mL 某NaCl溶液,正极反应式为 。在电解一段时间后,NaCl溶液的pH值变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为 mol。
③取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H3 0(填“>”、“<”或“=”)。
(3)脱硫。燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成硫酸铵。硫酸铵水溶液呈酸性的原因是 (用离子方程式表示);室温时,向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+) c(NH3·H2O)。(填“>”、“<”或“=”)
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H1=-574 kJ·mol-1 ①
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H2=-1160 kJ·mol-1 ②
甲烷直接将NO2还原为N2的热化学方程式为 。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3


①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。回答:0~10 min内,氢气的平均反应速率为 mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 (填“正向”、“逆向”或“不”)移动。
②如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解300mL 某NaCl溶液,正极反应式为 。在电解一段时间后,NaCl溶液的pH值变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为 mol。
③取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H3 0(填“>”、“<”或“=”)。
(3)脱硫。燃煤废气经脱硝、脱碳后,与一定量氨气、空气反应,生成硫酸铵。硫酸铵水溶液呈酸性的原因是 (用离子方程式表示);室温时,向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,则所得溶液中微粒浓度大小关系c(Na+) c(NH3·H2O)。(填“>”、“<”或“=”)
(1)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ?mol-1(2分)
(2)①0.225 (2分);正向(2分)
②O2 + 4e-+ 4H+=2H2O(2分);0.005 (2分);
③<(2分)
(3)NH4++H2O NH3·H2O+H+(2分);=(2分)
NH3·H2O+H+(2分);=(2分)
(2)①0.225 (2分);正向(2分)
②O2 + 4e-+ 4H+=2H2O(2分);0.005 (2分);
③<(2分)
(3)NH4++H2O
 NH3·H2O+H+(2分);=(2分)
NH3·H2O+H+(2分);=(2分)试题分析:(1)根据盖斯定律,将①+②相加除以2即得所求方程式,所以甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ?mol-1
(2)①由图1知甲醇的浓度在10min内增加0.75mol/L,所以氢气浓度减少3×0.75mol/L,0~10 min内,氢气的平均反应速率为3×0.75mol/L/10min="0.225" mol/(L·min);向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),反应物浓度增大,平衡正向移动;
②正极发生还原反应,氧气得电子结合氢离子成为水,电极反应式为O2 + 4e-+ 4H+=2H2O;NaCl溶液的pH值变为13,说明c(NaOH)=0.1mol/L,其物质的量为0.03mol,说明生成氯气0.015mol,转移电子0.03mol,根据得失电子守恒,每消耗1mol甲醇的物质的量是0.005mol;
③图3的最高点意味着达平衡时甲醇的体积分数,随温度升高,甲醇体积分数减小,说明升温平衡逆向移动,所以正向为放热反应,△H3<0;
(3)硫酸铵水溶液呈酸性的原因是铵根离子水解使溶液显酸性,离子方程式为NH4++H2O
 NH3·H2O+H+;室温时,向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,则有c(OH-)= c(H+),根据电荷守恒,c(Na+)+c(H+)+c(NH4+)= c(OH-)+2c(SO42-),所以c(Na+)+c(NH4+)= 2c(SO42-),再根据物料守恒得2c(SO42-)=c(NH4+)+c(NH3·H2O),两式结合可得c(Na+)= c(NH3·H2O)。
NH3·H2O+H+;室温时,向(NH4)2SO4,溶液中滴人NaOH溶液至溶液呈中性,则有c(OH-)= c(H+),根据电荷守恒,c(Na+)+c(H+)+c(NH4+)= c(OH-)+2c(SO42-),所以c(Na+)+c(NH4+)= 2c(SO42-),再根据物料守恒得2c(SO42-)=c(NH4+)+c(NH3·H2O),两式结合可得c(Na+)= c(NH3·H2O)。
练习册系列答案
相关题目

 [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0
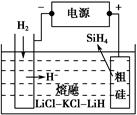
 Si(s)+3HCl(g)。
Si(s)+3HCl(g)。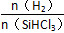 时,反应物X的平衡转化率关系如图所示。
时,反应物X的平衡转化率关系如图所示。
 NH3·H2O+H+达到平衡后,升高温度平衡正向移动
NH3·H2O+H+达到平衡后,升高温度平衡正向移动
 2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大
2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大