题目内容
8.下列反应的离子方程式正确的是( )| A. | 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| B. | 氢氧化铁与足量的氢碘酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| D. | 向100mL 1mol/L FeBr2溶液中通入0.25mol Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
分析 A.二者恰好反应生成硫酸钡、一水合氨和水,漏掉了生成一水合氨的反应;
B.铁离子将碘离子氧化成碘单质;
C.氢氧化钠足量,反应生成碳酸钙沉淀、碳酸钠和水;
D.溴化亚铁的物质的量为0.1mol,0.1mol溴化亚铁完全反应最多消耗0.15mol氯气,说明氯气过量,亚铁离子和溴离子完全反应.
解答 解:A.等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应生成硫酸钡、一水合氨和水,漏掉了生成一水合氨的反应,正确的离子方程式为:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3•H2O+H2O,故A错误;
B.氢氧化铁与足量的氢碘酸溶液发生氧化还原反应,正确的离子方程式为:2Fe(OH)3+2I-+6H+═2Fe2++I2↑+6H2O,故B错误;
C.Ca(HCO3)2溶液与足量NaOH溶液反应的离子方程式为:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O,故C正确;
D.100mL 1mol/L FeBr2溶液中含有0.1mol溴化亚铁,0.1mol溴化亚铁完全反应最多消耗0.15mol氯气,则氯气过量,亚铁离子和溴离子完全反应,正确的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,该题是高考的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
19.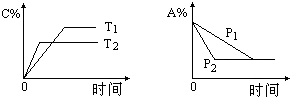 可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
 可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )
可逆反应:aA(g)+bB(s)?cC(g)+d D(g),当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是( )| A. | T1<T2 △H>0 | B. | T1>T2 △H<0 | ||
| C. | P1<P2 a=c+d | D. | P1<P2 a+b=c+d |
13.将大小相同、质量相等的镁条放入下列溶液中,反应速率按由大到小顺序排列正确的是 已知:醋酸的K a=1.8×10-5,亚硫酸的K a1=1.54×10-2.( )
①2mol/L H2SO3 ②2mol/L HAc
③2mol/L的HAc中加入少量的NaAc固体 ④2mol/L的盐酸.
①2mol/L H2SO3 ②2mol/L HAc
③2mol/L的HAc中加入少量的NaAc固体 ④2mol/L的盐酸.
| A. | ①③②④ | B. | ④①②③ | C. | ④①③② | D. | ①④③② |
20.下列各选项中两种粒子所含电子数不相等的是( )
| A. | 羟基(-OH)和氢氧根(OH-) | B. | 亚硝酸(HNO2)和亚硝酸根(NO2?) | ||
| C. | 硝基(-NO2)和二氧化氮(NO2) | D. | 羟甲基(-CH2OH)和甲氧基(CH3O-) |
17.一定温度下,1mol X和n mol Y在容积为2L的密闭容器中发生如下反应:X(g)+Y(g)?2Z(g)+M(s),5min后达到平衡,此时生成2amolZ,下列说法正确的是( )
| A. | 其他条件不变,向平衡后的体系中加入1mol M,平衡向逆反应方向移动 | |
| B. | 其他条件不变,向平衡体系中再充入1mol X,v(正)增大,v(逆)减小,平衡正向移动 | |
| C. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 | |
| D. | 用X表示此反应的反应速率是(0.1-0.2a)mol•L-1min-1 |
18.米易龙潭溶洞景区被誉为天然氧吧,其原因是空气中的自由电子附着在分子或原子上形成空气负离子,被称为“空气维生素”.O2-就是一种空气负离子,其摩尔质量为( )
| A. | 32 g | B. | 33 g/mol | C. | 33 g | D. | 32 g/mol |

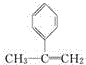 ,
,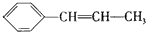 ,
, ;
; ,
,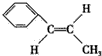 .
.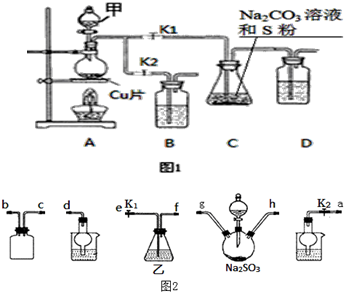
 按如图所示的装置和以下实验步骤,可以制取少量的溴苯和溴乙烷.已知乙醇在一定条件下与氢溴酸反应可制备溴乙烷:
按如图所示的装置和以下实验步骤,可以制取少量的溴苯和溴乙烷.已知乙醇在一定条件下与氢溴酸反应可制备溴乙烷: