题目内容
【题目】由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态 Cl原子核外电子占有的原子轨道数为______个,P、S、Cl的第一电离能由大到小顺序为______。
(2)SCl2分子中的中心原子杂化轨道类型是______,该分子构型为______。
(3)PH4Cl的电子式为______,Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为______。
(4)已知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO______NiO(填“>”、“<”或“=”),理由是______。
(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为______。
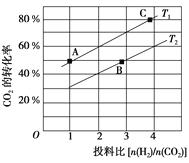
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图2),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为______g。(用a、NA表示)

【答案】 9 Cl>P>S sp3 V形 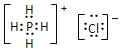 1:1 > Mg2+半径比Ni2+小,MgO的晶格能比NiO大 (1,1/2,1/2)
1:1 > Mg2+半径比Ni2+小,MgO的晶格能比NiO大 (1,1/2,1/2) ![]()
【解析】(1)基态Cl原子的电子排布式是1S22S22P63S23P5,S能级有1个原子轨道,P能级有3个原子轨道,所以共占据9个原子轨道;同周期元素第一电离能从左到右有增大的趋势,第一电离能排序时,P元素电子排布有半充满结构,第一电离能较高,高于S元素而低于Cl元素,所以P、S、Cl的第一电离能由大到小顺序为Cl>P>S。答案为:9、 Cl>P>S
(2)SCl2中S原子杂化轨道数为![]() (6+2)=4,采取 sp3杂化方式,两对孤对电子对,所以该分子构型为V形,答案为:sp3;V形;
(6+2)=4,采取 sp3杂化方式,两对孤对电子对,所以该分子构型为V形,答案为:sp3;V形;
(3)PH4+结构类似于NH4+,PH4Cl是离子化合物,据此写出其电子式![]() ;
;
每个CO分子内含有1个σ键和2个π键,而每个CO分子同时又通过1个σ配位键与Ni原子连接,所以σ键和π键之比为1:1。答案为:![]() 、 1:1
、 1:1
(4)晶体结构相同时,离子半径越小离子键强度越高,Mg2+半径比Ni2+小,MgO的晶格能比NiO大,熔点MgO >NiO。答案为:>、Mg2+半径比Ni2+小,MgO的晶格能比NiO大
(5)题中已经给出了坐标系的三个方向示意图,晶胞是边长为1的正方体,因此C点坐标是(1,![]() ,
,![]() )。答案为:(1,1/2,1/2)
)。答案为:(1,1/2,1/2)
(6)图中的单分子层可以如图画出一维重复单元:
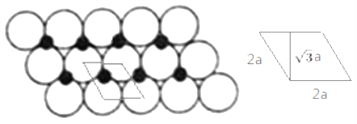
重复单元呈平行四边形,是相邻四个O原子球中心的连线,每个重复单元包含1个O原子和1个Ni原子,NiO相对分子质量为75。重复单元所占的平行四边形面积:![]() ,则1平方米上该晶体质量为:
,则1平方米上该晶体质量为: ![]() 。答案为:
。答案为:![]()