题目内容
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li+ + FeS + 2e- ="=" Li2S + Fe ,有关该电池的下列叙述中正确的是
- A.该电池的电池反应式为:2Li + FeS ="=" Li2S + Fe
- B.Li-Al合金在电池中作为正极材料
- C.负极的电极反应式为:Al — 3e- ="=" Al3+
- D.Li-Al/FeS电池中,电子经外电路流入Li-Al极
A
本题考查原电池知识。从组成材料看,负极应该是单质锂,Li-Al合金在电池中作为负极材料,故B错;电极反应为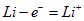 ,充电时,阴极即为原电池的负极,但是反应恰好相反:
,充电时,阴极即为原电池的负极,但是反应恰好相反: ,故C,D项不正确。排除后选A。
,故C,D项不正确。排除后选A。
本题考查原电池知识。从组成材料看,负极应该是单质锂,Li-Al合金在电池中作为负极材料,故B错;电极反应为
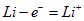 ,充电时,阴极即为原电池的负极,但是反应恰好相反:
,充电时,阴极即为原电池的负极,但是反应恰好相反: ,故C,D项不正确。排除后选A。
,故C,D项不正确。排除后选A。 
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
