题目内容
【题目】已知(Ⅰ)、(Ⅱ)反应在一定条件下焓变及平衡常数如下:
2H2(g)+S2(g)2H2S(g) ΔH1 K1 (Ⅰ)
3H2(g)+SO2(g)2H2O(g)+H2S(g) ΔH2 K2 (Ⅱ)
(1)用ΔH1、ΔH2表示反应4H2(g)+2SO2(g)=S2(g)+4H2O(g)的ΔH=________。
(2)回答下列反应(Ⅰ)的相关问题:
①温度为T1,在1 L恒容容器中加入1.8 mol H2、1.2 mol S2,10 min时反应达到平衡。测得10 min内v(H2S)=0.08 mol·L-1·min-1,则该条件下的平衡常数为________。
②温度为T2时(T2>T1),在1 L恒容容器中也加入1.8 mol H2、1.2 mol S2,建立平衡时测得S2的转化率为25%,据此判断ΔH1________0(填“>”或“<”),与T1时相比,平衡常数K1__(填“增大”“减小”或“不变”)。
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是________________(写出主要反应的离子方程式),该溶液中,c(Na+)______2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
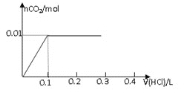
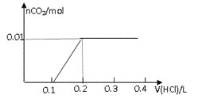
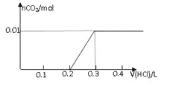
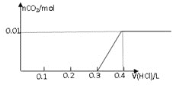
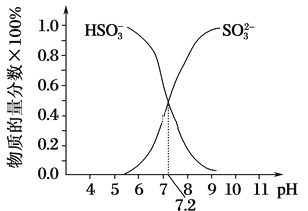
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的水解平衡常数=________。
【答案】2ΔH2-ΔH1 0.8 < 减小 SO32-+H2OHSO3-+OH- > 10-6.8
【解析】
(1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,构造目标热化学方程式,反应热也进行相应的计算;
(2)①计算硫化氢物质的量变化量,利用三段式计算平衡时各组分的物质的量,由于容器体积为1L,用物质的量代替浓度代入平衡常数K=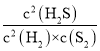 计算;
计算;
②根据①中的计算数据,可以计算①中平衡时S2(g)的转化率,再根据转化率判断平衡移动方向,升高温度平衡向吸热反应方向移动,据此分析解答;
(3)①Na2SO3水溶液中亚硫酸根水解,使溶液显碱性;根据电荷守恒判断离子浓度关系;
②亚硫酸根离子的水解平衡常数K=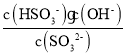 ,当pH=7.2时,SO32-、HSO3-浓度相等,据此计算。
,当pH=7.2时,SO32-、HSO3-浓度相等,据此计算。
(1)2H2(g)+S2(g)2H2S(g) ΔH1 K1 (Ⅰ)
3H2(g)+SO2(g)2H2O(g)+H2S(g) ΔH2 K2 (Ⅱ)
根据盖斯定律,由(Ⅱ)×2(Ⅰ)可得:4H2(g)+2SO2(g)S2(g)+4H2O(g),故△H=2ΔH2-ΔH1,故答案为:2ΔH2-ΔH1;
(2)①10min时反应达到平衡。测得10min内v(H2S)=0.08molL1min1,故△n(H2S)=0.08molL1min1×10min×1L=0.8mol,则:
2H2(g)+S2(g)2H2S(g)
起始(mol): 1.8 1.2 0
变化(mol): 0.8 0.4 0.8
平衡(mol): 1.0 0.8 0.8
由于容器体积为1L,用物质的量代替浓度计算平衡常数,故平衡常数K=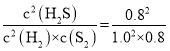 =0.8;故答案为:0.8;
=0.8;故答案为:0.8;
②根据①中数据,可知温度为T1时S2的转化率=![]() =33.3%>25%,说明升温平衡逆向移动,故正反应为放热反应,即△H1<0,平衡常数减小,故答案为:<;减小;
=33.3%>25%,说明升温平衡逆向移动,故正反应为放热反应,即△H1<0,平衡常数减小,故答案为:<;减小;
(3)①溶液中SO32会发生水解反应,其离子方程式为:SO32-+H2OHSO3-+OH-,破坏水的电离平衡,导致溶液显示碱性;根据电荷守恒,溶液中c(H+)+c(Na+)=2c(SO32-)+c(HSO3-)+c(OH),因c(H+)<c(OH),故c(Na+)>2c(SO32-)+c(HSO3-),故答案为:SO32-+H2OHSO3-+OH-;>;
②亚硫酸根离子的水解平衡常数K=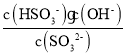 ,当pH=7.2时,SO32-、HSO3-浓度相等,所以K=c(OH)=
,当pH=7.2时,SO32-、HSO3-浓度相等,所以K=c(OH)=![]() =10-6.8,故答案为:106.8。
=10-6.8,故答案为:106.8。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】(1)比较下列粒子的半径大小
①Na Mg O F __________
②Na+ Mg2+ O2- F-__________
③Fe Fe2+ Fe3+__________
④Na+ Mg2+ S2- Cl-__________
(2)下列物质中:只存在共价键的是__________(填序号,下同),只存在离子键的是__________,既存在离子键又存在极性共价键的是__________,既存在离子键又存在非极性共价键的是__________。
①Ar ②CO2 ③Na2O2 ④KOH ⑤MgBr2 ⑥NH4Cl ⑦CaO ⑧H2SO4
(3)氢气可由天然气和水反应制备,其主要反应为:CH4(g)+ 2H2O(g) ===CO2(g)+4H2(g) 反应过程中能量变化如图所示,则该反应为__________反应(填“吸热”或“放热”)。若已知,破坏1mol化学键需要吸收的热量如代数式表示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | a | b | c | d |

则根据该反应制取1mol H2要吸收或放出热量为___________kJ(用含a、b、c、d字母表示)。
【题目】一定温度下,在密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如表所示,下列说法不正确的是
物质 | X | Y | Z | W |
初始浓度/mol·L-1 | 0.5 | 0.5 | 0 | 0 |
平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.4 |
A. 反应达到平衡时,X的体积分数为10%
B. 该温度下反应的平衡常数K=16
C. 保持温度不变增大压强,反应速率加快,平衡向正反应方向移动
D. 若X、Y的初始浓度均为0.8 mol·L-1,则达到平衡时,W的浓度为0.64 mol·L-1
【题目】将E(g)和F(g)加入密闭容器中,在一定条件下发生反应:E(s)+4F(g)G(g),已知该反应的平衡常数如表所示。下列说法正确的是( )
温度/℃ | 25 | 80 | 230 |
平衡常数/(L3·mol-3) | 5×104 | 2 | 1.9×10-5 |
A.上述反应是熵增反应
B.25 ℃时,反应G(g)E(s)+4F(g)的平衡常数是0.5 mol3·L-3
C.在80 ℃时,测得某时刻,F、G的浓度均为0.5 mol·L-1,则此时v正>v逆
D.恒温恒容下,向容器中再充入少量G(g),达新平衡时,G的体积百分含量将增大