题目内容
【题目】草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4—、C2O42—,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
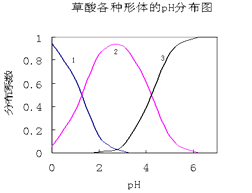
(1)图中曲线1表示________________的分布系数变化。
(2)现有物质的量浓度均为0.1mol/L的下列溶液:
a. Na2C2O4 b. NaHC2O4 c. H2C2O4 d. (NH4)2C2O4 e. NH4HC2O4
已知NaHC2O4溶液显酸性。
①NH4HC2O4显_____性(填“酸”、“碱”或“中”)
②Na2C2O4溶液中,![]() ____2 (填“>”、“=”、“<”), 原因是______________________________________________(用离子方程式表示)。
____2 (填“>”、“=”、“<”), 原因是______________________________________________(用离子方程式表示)。
③常温下,向10 mL 0. 1 mol/L H2C2O4溶液中滴加0.1 mol/L NaOH溶液,随着NaOH溶液体积的增加,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,溶液显_______性(填“酸”、“碱”或“中”),且V(NaOH)______10 mL(填“>”、“=”或“<”)。
④五种溶液中c(H2C2O4)由大到小排列的顺序是 ________________________________。
【答案】 H2C2O4 酸 > C2O42-+H2O![]() HC2O4-+OH- 中 > c > e > b > d > a
HC2O4-+OH- 中 > c > e > b > d > a
【解析】(1). 因草酸的浓度越大,溶液的pH越小,根据图象可知,曲线1随pH的增大而逐渐降低,所以曲线1为草酸,故答案为:H2C2O4;
(2). ①. 因NaHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解程度,因铵根离子水解也会使溶液显酸性,所以NH4HC2O4溶液显酸性,故答案为:酸;
②. 草酸钠中的草酸根离子是弱酸阴离子,可以发生水解反应C2O42-+H2O![]() HC2O4-+OH-,所以草酸钠溶液中
HC2O4-+OH-,所以草酸钠溶液中![]() >2,故答案为:>;C2O42-+H2O
>2,故答案为:>;C2O42-+H2O![]() HC2O4-+OH-;
HC2O4-+OH-;
③. 根据电荷守恒可知:c(Na+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-),当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,c(H+)=c(OH-),所以溶液呈中性;草酸氢钠溶液呈酸性,要使溶液呈中性,则氢氧化钠溶液应稍微过量,所以V(NaOH)>10mL,故答案为:中;>;
④. 草酸根离子水解程度大于草酸氢根离子、铵根离子促进草酸根离子或草酸氢根离子水解,草酸电离程度较小,所以溶液中c(H2C2O4)由大到小排列的顺序是c>e>b>d>a,故答案为:c>e>b>d>a。




