题目内容
【题目】在实验室中MnO2跟足量12.0 mol·L-1浓盐酸反应制得2.24 L氯气(标准状况下)。
(1)用双线桥表示该反应电子的得失数目________________________________。
(2)被氧化的HCl的物质的量为__________ mol;注:在答题纸上写出计算过程。
【答案】  0.2
0.2
【解析】(1)MnO2与浓盐酸反应时,MnO2中的Mn得到电子,HCl中的Cl失去电子,先写好化学方程式,分析知反应中有两个电子转移,用双线桥表示如下: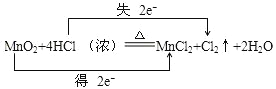 。
。
(2)标准状况下2.24 L氯气的物质的量为0.1mol,由化学方程式可知参加反应的HCl的物质的量为0.4mol,方程式中4个-1价的Cl只有两个Cl原子的化合价升高到0价,即被氧化的HCl的物质的量为参加反应的HCl的物质的量的一半,所以被氧化的HCl的物质的量为0.4mol×1/2=0.2mol。

练习册系列答案
相关题目

