题目内容
【题目】I.某研究性学习小组根据反应: 2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O。设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。

回答下列问题:
(1)此原电池的正极是石墨________(填“a”或“b”),发生________反应。
(2)电池工作时,盐桥中的SO42-移向________(填“甲”或“乙”)烧杯。
(3)两烧杯中的电极反应式分别为
甲_____________________;
乙____________________。
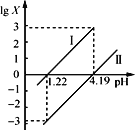
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为________mol。
Ⅱ.次磷酸钴(II)[Co(H2PO2)2]广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如图。
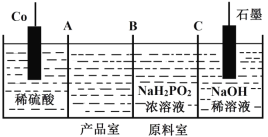
(5)A、B、C均为离子交换膜,其中为阳离子交换膜的是____________。
(6)阳极的电极反应式为________________。
(7)电解一段时间后,阴极室溶液的pH______(填“增大”“减小”或“不变”)。
(8)用Co(H2PO2)2溶液化学镀钴是在强碱性条件下通过发生自身氧化还原反应,反应的同时会生成HPO32-,其离子方程式为__________。
【答案】a 还原 乙 MnO4-+5e-+8H+=Mn2++4H2O 5Fe2+-5e-=5Fe3+ 0.5 A C Co-2e-=Co2+ 增大 Co2++ H2 PO2-+3OH- =Co+ HPO32-+ 2H2O
【解析】
I. (1)根据题目提供的总反应方程式可知,KMnO4作氧化剂,发生还原反应;
(2)电池工作时,SO42-向负极移动;
(3)甲烧杯中的电极反应式为MnO4-+5e-+8H+=Mn2++4H2O;乙烧杯中的电极反应式为5Fe2+-5e-=5Fe3+;
(4)溶液中的MnSO4浓度由1 mol·L-1变为1.5 mol ·L-1,由于溶液的体积未变,则反应过程中生成的MnSO4的物质的量为0.5 mol·L-1×0.2 L=0.1 mol,根据得失电子守恒计算;
Ⅱ.(5)以金属钴和次磷酸钠为原料,采用四室3个离子透过膜电渗析槽电解法制备次磷酸钴[Co(H2PO2)2],由图可知,负极上Co失去电子生成Co2+,通过膜A进入产品室,Na+通过膜C进入阴极室;
(6)Co为阳极,失去电子发生氧化反应,电极反应式为Co-2e-=Co2+;
(7)阴极室NaOH溶液中H2O(或H+)得到电子生成H2,电极反应式为2H2O+2e-=2OH-+H2↑(或2H++2e-=H2↑,促进水的电离生成NaOH);
(8)强碱性条件下,Co(H2PO2)2自身发生氧化还原反应生成Co和HPO32-,据此写反应d离子方程式。
I. (1)根据题目提供的总反应方程式可知,KMnO4作氧化剂,发生还原反应,故石墨a是正极,故答案为:a;还原;
(2)电池工作时,SO42-向负极移动,即向乙烧杯移动,故答案为:乙;
(3)甲烧杯中的电极反应式为MnO4-+5e-+8H+=Mn2++4H2O;乙烧杯中的电极反应式为5Fe2+-5e-=5Fe3+,故答案为:MnO4-+5e-+8H+=Mn2++4H2O;5Fe2+-5e-=5Fe3+;
(4)溶液中的MnSO4浓度由1 mol·L-1变为1.5 mol ·L-1,由于溶液的体积未变,则反应过程中生成的MnSO4的物质的量为0.5 mol·L-1×0.2 L=0.1 mol,转移的电子为0.1 mol×5=0.5 mol,故答案为:0.5;
Ⅱ.(5)以金属钴和次磷酸钠为原料,采用四室3个离子透过膜电渗析槽电解法制备次磷酸钴[Co(H2PO2)2],由图可知,负极上Co失去电子生成Co2+,通过膜A进入产品室,Na+通过膜C进入阴极室,故答案为:AC;
(6)Co为阳极,失去电子发生氧化反应,电极反应式为Co-2e-=Co2+,故答案为:Co-2e-=Co2+;
(7)阴极室NaOH溶液中H2O(或H+)得到电子生成H2,电极反应式为2H2O+2e-=2OH-+H2↑(或2H++2e-=H2↑,促进水的电离生成NaOH),使溶液中c(OH-)增大,pH增大,故答案为:增大;
(8)强碱性条件下,Co(H2PO2)2自身发生氧化还原反应生成Co和HPO32-,反应d离子方程式为Co2++ H2 PO2-+3OH- =Co+ HPO32-+ 2H2O,故答案为:Co2++ H2 PO2-+3OH- =Co+ HPO32-+ 2H2O。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
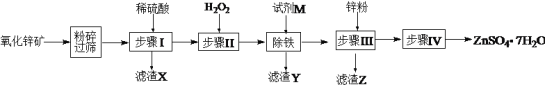
小博士期末闯关100分系列答案【题目】七水硫酸锌别名皓矾,常用作媒染剂、收敛剂、木材防腐剂。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的流程如下:
在该流程中,相关离子生成氢氧化物的pH如表:
开始沉淀时pH | 完全沉淀时pH | |
Zn2+ | 5.4 | 6.4 |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Cu2+ | 5.6 | 6.4 |
请回答下列问题:
(1)粉碎氧化锌矿石的目的是______________;滤渣X的成分是________________。
(2)步骤Ⅱ中加入H2O2目的是:_______________,发生反应的离子方程式为:______________。
(3)“除铁”步骤中加入试剂M调节溶液的pH,试剂M可以是________(填化学式,一种即可),控制溶液的pH范围为:_________。同时还需要将溶液加热,其目的是:__________。
(4)滤渣Z的成分是____________。
(5)取28.70 g ZnSO4·7H2O(相对分子质量:287)加热至不同温度,剩余固体的质量变化如图所示:
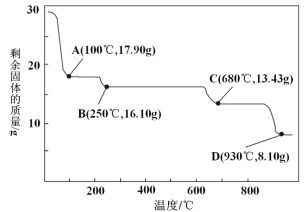
①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是____________。
②680 ℃时所得固体的化学式为________________。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O