题目内容
(8分)如下图所示物质间的相互转变关系,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应.常温下D、E、G均是气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%.
请回答下列问题:
(1)写出F的化学式:________________.
(2)人们将反应①涉及的化学工业称为 ________________.
(3)写出B与D反应的离子方程式____________________________________ ____.
____.
(4)写出反应④的离子方程式____________________________ __________________.
__________________.
(5)写出反应⑤的离子方程式_____________________________________________ _.
_.
(6)高铁酸钠(Na2FeO4)被人们认为是一种“绿色环保高效”的净水剂,其原因为:
①Na2FeO4具有强氧化性可杀菌消毒;
②___________________________________________________________________

请回答下列问题:
(1)写出F的化学式:________________.
(2)人们将反应①涉及的化学工业称为 ________________.
(3)写出B与D反应的离子方程式____________________________________
 ____.
____.(4)写出反应④的离子方程式____________________________
 __________________.
__________________.(5)写出反应⑤的离子方程式_____________________________________________
 _.
_.(6)高铁酸钠(Na2FeO4)被人们认为是一种“绿色环保高效”的净水剂,其原因为:
①Na2FeO4具有强氧化性可杀菌消毒;
②___________________________________________________________________
(1) NaClO(1分)
(2)氯碱工业(1分)
(3)Cl2+ H2O = H++Cl-+HClO (1分 )
(4)Fe2O3+6 H+=2Fe3++3H2O(1分)
(5)2Fe3++3ClO-+10OH-===2FeO+3Cl-+5H2O(2分)
(6)Na2FeO4被还原为Fe3+、Fe3+水解生成Fe(OH)3胶体能吸附水中的悬浮物和杂质形成沉淀,使水澄清(2分)
(2)氯碱工业(1分)
(3)Cl2+ H2O = H++Cl-+HClO (1分 )
(4)Fe2O3+6 H+=2Fe3++3H2O(1分)
(5)2Fe3++3ClO-+10OH-===2FeO+3Cl-+5H2O(2分)
(6)Na2FeO4被还原为Fe3+、Fe3+水解生成Fe(OH)3胶体能吸附水中的悬浮物和杂质形成沉淀,使水澄清(2分)
略

练习册系列答案
相关题目

 液并使它们接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。则
液并使它们接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。则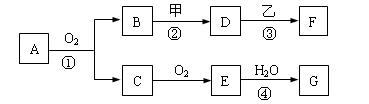
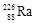 作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
作为标准,居里夫人(Marie Curie)因对Ra元素的研究两度获得诺贝尔奖。下列叙述中正确的是
 的热化学方程式为:
的热化学方程式为: ,b与c形成化合物的电子式为:
,b与c形成化合物的电子式为: ,下列比较中正确的是( )
,下列比较中正确的是( )