题目内容
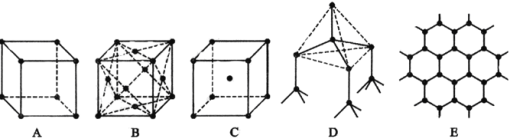
【题目】三氯化磷分子的空间构型是三角锥形而不是平面正三角形。下列关于三氯化磷分子空间构型理由的叙述,正确的是:( )
A.PCl3分子中三个共价键的键长相等
B.PCl3分子中的P—Cl键属于极性共价键
C.PCl3分子中三个共价键的键长、键角均相等,
D.PCl3分子中P—Cl键的三个键的键长相等,且属于极性分子
【答案】D
【解析】
试题分析:PCl3中P含有3个σ键,孤电子对数为(5-3×1)/2=1, VESPR模型为四面体,因为含有一个孤电子对,空间构型是三角锥形,属于极性分子,P-Cl键的键长相等,平面正三角形属于非极性分子,故选项D正确。

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
【题目】铁粉、铜粉混合物样品11.6g,逐步加入2.0 mol/L,的硫酸溶液,充分反应后剩余固体质量随加入硫酸溶液体积变化如下表:
硫酸溶液/mL | 20.0 | 40.0 | 60.0 | 80.0 |
剩余固体/g | 9.36 | 7.12 | 4.88 | 3.20 |
请回答:
(1)样品中铁与铜的物质的量之比n(Fe):n(Cu)=________ 。
(2)在反应后的体系中,再加入4.0mol/L的H2O2溶液25.0mL,并加入足量硫酸溶液.充分反应后溶液中存在的各金属离子的物质的量分别是多少?__________________