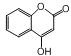
题目内容
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是_________________________________________。

(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用________溶液吸收多余的氯气,原理是(用化学方程式表示)_________________________________。根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是__________(化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是___________(字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
(3)据报道,某化工总厂最近相继发生氯气泄漏和爆炸事故,当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是____________。
A.NaOH B.NaCl C. KBr D. Na2CO3
【答案】 潮湿有色布条褪色而干燥有色布条不褪色 氢氧化钠(NaOH) 2NaOH+Cl2=NaClO+NaCl+H2O Ca(ClO)2 C D
【解析】试题分析:(1)氯气无漂白性,氯气与水反应生成的次氯酸具有漂白性;(2)利用氯气和氢氧化钠溶液反应来处理尾气;氯气和石灰乳反应生成氯化钙和次氯酸钙,长期露置于空气中的次氯酸钙可与空气中二氧化碳反应生成次氯酸和碳酸钙,碳酸钙与盐酸反应生成氯化钙和二氧化碳;(3)A.NaOH 具有强腐蚀性;B.NaCl不能溶解氯气; C. KBr与氯气反应生成碘单质,碘有毒 ; D. Na2CO3溶液呈碱性,能吸收氯气。
解析:(1)氯气无漂白性,干燥的有色布条无明显现象,氯气与水反应Cl2+H2O= HCl+HClO 生成的次氯酸具有漂白性,所以可观察到潮湿有色布条的广口瓶的现象是有色布条褪色;(2)为了防止氯气尾气污染空气,可用NaOH溶液吸收,该反应的化学方程式为Cl2+2NaOH= NaCl+NaClO +H2O;漂白粉的主要成分为氯化钙和次氯酸钙,Ca(ClO)2为有效成分,Ca(ClO)2可与空气中二氧化碳反应生成次氯酸和碳酸钙,次氯酸不稳定,分解生成盐酸和氧气,在长期露置于空气中已完全失效的漂白粉,加稀盐酸后产生的气体是二氧化碳,故选C;(3)A.NaOH 具有强腐蚀性;B.NaCl不能溶解氯气; C. KBr与氯气反应生成碘单质,碘有毒 ; D. Na2CO3溶液呈碱性,能吸收氯气,最适宜采用的该物质是碳酸钠,故D正确。

【题目】一氧化碳是一种用途相当广泛的化工基础原料。
⑴. 利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)![]() Ni(CO)4(g) 该反应的ΔH_______0(选填“>”或“=”或“<”)。
Ni(CO)4(g) 该反应的ΔH_______0(选填“>”或“=”或“<”)。
⑵. 在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g);ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g);ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)=SO2(g);ΔH3=-296.0 kJ·mol-1
则2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH4=________。
⑶. 工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测
得c(CO)=0.2mol·L-1,则CO的转化率为___________。
合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160。此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
比较此时正、逆反应速率的大小:v正_______v逆 (填“>”、“<”或“=”);若其他条件不变,在T2℃反应10min后达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率:
v(CH3OH) =__________;
(4)金属氧化物被一氧化碳还原生成金属单质和二氧化碳。下图是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。800℃时,其中最易被还原的金属氧化物是____(填化学式),该反应的平衡常数数值(K)等于____________。