题目内容
【题目】某实验室需要配制500mL 0.10mol/L Na2CO3溶液. 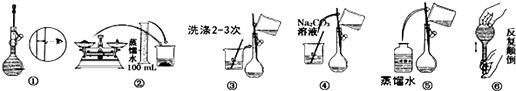
(1)所需玻璃仪器有:玻璃棒、烧杯、100mL量筒、、
(2)实验时图中所示操作的先后顺序为(填编号)
(3)在配制过程中,下列操作对所配溶液浓度有无影响?(填“偏高”、“偏低”或“无影响”)
①称量时误用“左码右物”
②转移溶液后没有洗涤烧杯和玻璃棒
③向容量瓶加水定容时俯视液面
④摇匀后液面下降,再加水至刻度线
(4)所需Na2CO3固体的质量为g;若改用浓溶液稀释,需要量取2mol/L Na2CO3溶液mL.
【答案】
(1)500mL容量瓶;胶头滴管
(2)②④③⑤①⑥
(3)偏低;偏低;偏高;偏低
(4)5.3;25.0
【解析】解:(1)实验室需要配制500mL 0.10mol/L Na2CO3溶液,应选择500mL容量瓶,操作步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还缺少的玻璃仪器为:500mL容量瓶,胶头滴管;所以答案是:500mL容量瓶,胶头滴管;(2)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,所以正确的操作步骤为:②④③⑤①⑥;
所以答案是:②④③⑤①⑥;(3)①称量时误用“左码右物”,依据托盘天平原理:左盘的质量=右盘的质量+游码的质量,所以实际称取的质量=砝码的质量﹣游码的质量,称取的溶质的质量偏小,溶质的物质的量偏小,溶液浓度偏低;
所以答案是:偏低;②转移溶液后没有洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,溶液浓度偏低;
所以答案是:偏低;③向容量瓶加水定容时俯视液面,导致溶液体积偏小,溶液的物质的量浓度偏高;
所以答案是:偏高;④摇匀后液面下降,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低;
所以答案是:偏低;(4)实验室需要配制500mL 0.10mol/L Na2CO3溶液,应选择500mL容量瓶,实际配制500mL溶液,需要碳酸钠的质量m=0.10mol/L×106g/mol×0.5L=5.3g;
若改用浓溶液稀释,设需要量取2mol/L Na2CO3溶液体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得V×2mol/L=0.10mol/L×500mL,解得V=25.0mL;
所以答案是:5.3;25.0.

 阅读快车系列答案
阅读快车系列答案
