题目内容
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。已知:阳离子交换膜只允许阳离子通过,阴离子不能通过,离子交换过程中溶液电荷守恒 。下列说法正确的是( )

A. 正极反应为AgCl+e-=Ag+Cl-
B. 电池工作时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用KCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.2 mol e-时,交换膜左侧溶液中约减少0.4 mol离子
【答案】D
【解析】试题分析:A、正极氯气得到电子,正极反应式为Cl2+2e-=2Cl-,A错误;B、由于阳离子交换膜只允许阳离子通过,故在左侧溶液中才会有大量白色沉淀生成,B错误;C、若用KCl溶液代替盐酸,电池总反应不变,C错误;D、当电路中转移0.2 mol e-时,交换膜左侧产生0.2 mol Ag+与盐酸反应产生AgCl沉淀,同时约有0.2 mol H+通过阳离子交换膜转移到右侧溶液中,故左侧溶液共约0.4mol离子减少,D正确。答案选D。

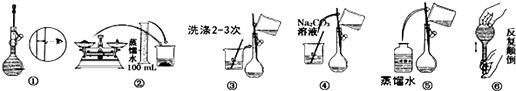
【题目】如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
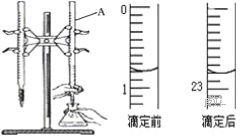
(1)仪器A的名称是__________________;
(2)盐酸的体积读数:滴定前读数为_____mL,滴定后读数为______mL;
(3)某实验小组同学的三次实验的实验数据如下表所示.根据表中数据计算出的待测NaOH溶液的浓度是________________;(保留四位有效数字)
实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数mL) | 滴定后盐酸的 体积读数(mL) |
1 | 20.00 | 1.20 | 23.22 |
2 | 20.00 | 2.21 | 24.21 |
3 | 20.00 | 1.50 | 23.48 |
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)_____________;
(5)判断到达滴定终点的实验现象是________________________________。
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①如果上述B步骤省略,对测定结果的影响是_________;
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失._________;
③若滴定前锥形瓶未用待测液润洗,对测定结果的影响是___________;
④标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是___________.
【题目】在一密闭容器中加入A,B两种气体,保持一定温度,在t1、t2、t3、t4时刻测得各物质的浓度如下:据此下列结论中正确的是( )
测定时刻/s | t1 | t2 | t3 | t4 |
C(A)/molL﹣1 | 6 | 3 | 2 | 2 |
C(B)/molL﹣1 | 5 | 3.5 | 3 | 3 |
C(C)/molL﹣1 | 1 | 2.5 | 3 | 3 |
A.在容器中发生的反应为2A(g)+B(g)2C(g)
B.该温度下,此反应的平衡常数为0.25
C.A的转化率比B转化率的低
D.在t3时刻反应已经停止