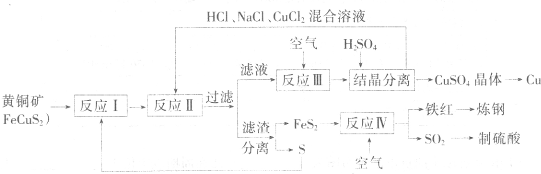
题目内容
硫酸厂为保护环境、保证生产须经常检查炉气中的SO2含量,方法是使炉气通过含淀粉的碘浓度为0.050 mol·L-1的溶液10 mL,使得溶液的蓝色恰好消失,此时剩余112 mL气体(标准状况).(1)写出化学反应方程式.
(2)求炉气中的SO2的体积分数.
答案:
解析:
解析:
| 解析:淀粉的作用是检验I2是否被完全反应.
n(I2)=0.050 mol·L-1×0.010 L=5.0×10-4 mol SO2+2H2O+I2====H2SO4+2HI n(SO2)=n(I2)=5.0×10-4 mol V(SO2)=22.4 L·mol-1×5.0×10-4 mol=1.1×10-2 L=11 mL φ(SO2)= 答案:(1)SO2+2H2O+I2====H2SO4+2HI (2)8.9%
|

练习册系列答案
相关题目