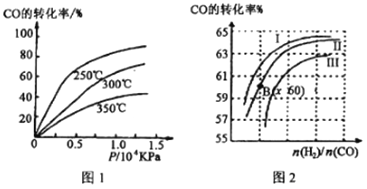
题目内容
【题目】某同学为测定维生素C中碳、氢的质量分数,取维生素C样品研碎,称取该试样0.352 g,置于铂舟并放入燃烧管中,不断通入氧气流。用酒精喷灯持续加热样品,将生成物先后通过浓硫酸和碱石灰,两者分别增重0.144 g和0.528 g,生成物完全被吸收。试回答以下问题:
(1)维生素C中碳的质量分数是_____________,氢的质量分数____________
(2)维生素中是否含有氧元素?为什么?(试通过计算说明)
(3)如果需要你确定维生素C的分子式,你还需要哪些信息?
【答案】(1)40.9%;4.5%;
(2)m(H)=0.144g×![]() ,
,
![]() ,
,
m(H)+m(C)=0.016g+0.144g=0.16g<0.352 g,
所以还含有氧元素;(3)维生素C的相对分子质量
【解析】试题分析:用酒精喷灯持续加热0.352 g维生素C样品,将生成物先后通过浓硫酸和碱石灰,生成物完全被吸收,两者分别增重0.144 g和0.528 g, 那么生成的水的质量为0.144g,生成的CO2的质量为0.528g,
(1)m(H)=0.144g×![]() ,氢元素的质量分数为:
,氢元素的质量分数为:![]() ;
;![]() ,碳元素的质量分数为:
,碳元素的质量分数为:![]() ,答案为:40.9%;4.5%;(2)根据(1)的计算m(H)+m(C)=0.016g+0.144g=0.16g<0.352 g,所以还含有氧元素,答案为:m(H)+m(C)=0.016g+0.144g=0.16g<0.352 g,含有O元素;(3)要确定维生素C的相对分子质量还需要知道维生素C的相对分子质量,答案为:维生素C的相对分子质量
,答案为:40.9%;4.5%;(2)根据(1)的计算m(H)+m(C)=0.016g+0.144g=0.16g<0.352 g,所以还含有氧元素,答案为:m(H)+m(C)=0.016g+0.144g=0.16g<0.352 g,含有O元素;(3)要确定维生素C的相对分子质量还需要知道维生素C的相对分子质量,答案为:维生素C的相对分子质量

【题目】某学习小组分析实验室制氯气的方法后认为:MnO2与FeCl3·6H2O共热能产生Cl2,于是设计了下列装置验证该结论。
【查阅资料】FeCl3·6H2O是棕黄色晶体,熔点37℃,沸点280~285℃。
【实验设计】
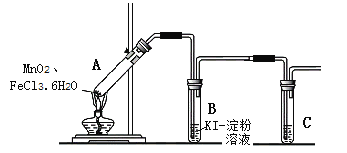
若结论成立,B中发生反应的化学方程式是___,C中的试剂是___。
【实验过程】
操作 | 现象 |
(1)经检查,装置气密性良好。 (2)添加药品,连接装置。 (3)点燃酒精灯。 | i.A中部分固体熔化,上方出现白雾; ii.稍后,产生黄色气体,管壁附着黄色液滴; iii.B中溶液变蓝。 |
【实验分析】
(1)小组讨论一致认为现象i中的白雾是盐酸小液滴,产生白雾的原因是___。
(2)分析现象ii时发生了分歧,有同学认为:FeCl3·6H2O是棕黄色,沸点不高,黄色气体重含有FeCl3也会导致B中溶液变蓝,反应的离子方程式是___。
小组同学通过下列实验证明现象ii的黄色气体中含有Fe3+,将下列实验补充完整:
a.只在A中加入FeCl3·6H2O,加热,开始产生白雾,稍后出现黄色气体,管壁仍有黄色液滴。
b.____________________________________ ,溶液变红。
(3)为进一步确认黄色气体含有 Cl2,小组在A、B 间增加盛有饱和氯化钠溶液的试管,气体依次通过饱和氯化钠溶液、KI淀粉溶液后,KI淀粉溶液变蓝,证实黄色气体中含有Cl2。饱和氯化钠溶液的主要作用是___。
(4)A中固体充分加热后得到Fe2O3和MnCl2,若物质的量之比为1:1,则A中总反应的化学方程式是________。从混合物中分离出Fe2O3的方法是:___。
【安全预案】在实验过程中,若试管B中溶液已经开始发生倒吸,应立即采取的一种措施是___ (填写编号)。
a.移去酒精灯
b.取下B中盛有溶液的试管
c.将A、B间的导管从乳胶管中取出