题目内容
【题目】磷及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)少量CO的存在会引起生产中催化剂中毒,常用SO2氧化CO,本身被还原为S。
已知:① Cc(s)+ 1/2O2 (g)=CO (g) △H1=-l26.4kJ·mol-1
②③C(s)+O2 (g) =CO2 (g) △H2=-393.5kJ·mol-1
@S(s)+O2 (g)=SO2 (g) △H3=-296.8kJ·mol-1
则SO2氧化CO的热化学反应方程式__________________。
(2) CO可用于合成甲醇,反应方程式CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
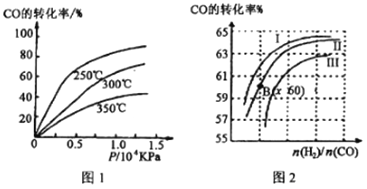
① CO转化率与温度、压强的关系如图所示,该反应△H_______0 (填“>”或“<”)
图2中曲线I、II、III对应的平衡常数分别为K1、K2、K3,则它们的大小关系为___________。测得B(x,60)点氢气的转化率为40%,则x=___________。
②一定条件下,将2molCO和2molH2置于容积为2L固定的密闭容器中发生上述反应,达到平衡时,CO与H2体积之比为2:1,则平衡常数K=___________。
(3)处理高浓度乙醛废水的原理:2CH3CHO+H2O![]() CH3CH2OH+CH3COOH。使用惰性电极电解,以一定浓度的CH3CHO –Na2SO4溶液为电解貭溶液模拟工业处理,其装置如图3所示:
CH3CH2OH+CH3COOH。使用惰性电极电解,以一定浓度的CH3CHO –Na2SO4溶液为电解貭溶液模拟工业处理,其装置如图3所示:
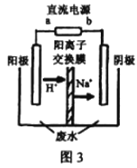
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别:4OH- -4e-=O2↑+2H2O;__________________。
②在实际处现过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入lm3乙醛的含量为300mg L-1的废水,可得到乙醇_______ kg(结果保留2位小数)。
【答案】 SO2(g) +2CO (g) =S(s)+2CO2 (g) △H=-237.4kJ ·mol-1 < K1>K2>K3 3 4.5L2·mol2 (不带单位不扣分) CH3CHO+H2O-2e-=CH3COOH+2H+ 0.19
【解析】(1)根据盖斯定律得,目标方程式=②×2-①×2-③,ΔH=(-393.5kJ/mol)×2-(-126.4kJ/mol)×2-(-296.8kJ/mol)=-237.4kJ/mol,所以所求热化学方程式为SO2(g)+2CO(g)=S(s)+2CO2(g) ΔH=-237.4kJ/mol;(2)①由图1可知,温度升高CO的转化率降低,说明升高温度,平衡逆向移动,正向是放热反应,ΔH<0;n(H2)/n(CO)一定时,CO的转化率Ⅰ>Ⅱ>Ⅲ,转化率高的平衡常数大,所以K1、K2、K3的大小关系为K1>K2>K3测得B(X,60)点氢气的转化率为40%,CO的转化率是60%,设B点时CO、H2的物质的量分别是m、n,可得60%m=![]() ,所以
,所以![]() =3,即x=3;
=3,即x=3;
②设平衡时CO的浓度是x,则氢气的浓度是2x-1,生成甲醇的浓度是1-x,根据题意得: ![]() =2:1,x=
=2:1,x=![]() mol/L,所以K=
mol/L,所以K=![]() =4.5 L2·mol-2;(3)①阳极发生氧化反应,乙醛被氧化为乙酸,氢氧根离子被氧化为氧气,则阴极发生还原反应,乙醛被还原为乙醇,同时氢离子被还原为氢气,所以阳极电极反应式除生成氧气外,还有CH3CHO-2e-+H2O═CH3COOH+2H+;②阴极反应是CH3CHO+2e-+2H+=CH3CH2OH,所以注入1m3乙醛的含量为300mg/L的废水,阴极区乙醛的去除率可达60%,生成乙醇的质量是1000L×300mg/L×60%×10-3g/mg÷44g/mol×46g/mol=188.2g=0.19kg。
=4.5 L2·mol-2;(3)①阳极发生氧化反应,乙醛被氧化为乙酸,氢氧根离子被氧化为氧气,则阴极发生还原反应,乙醛被还原为乙醇,同时氢离子被还原为氢气,所以阳极电极反应式除生成氧气外,还有CH3CHO-2e-+H2O═CH3COOH+2H+;②阴极反应是CH3CHO+2e-+2H+=CH3CH2OH,所以注入1m3乙醛的含量为300mg/L的废水,阴极区乙醛的去除率可达60%,生成乙醇的质量是1000L×300mg/L×60%×10-3g/mg÷44g/mol×46g/mol=188.2g=0.19kg。

 阅读快车系列答案
阅读快车系列答案