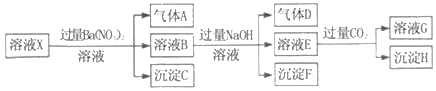
题目内容
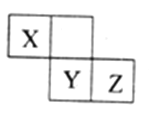
【题目】X、Y、Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子,下列说法不正确的是
A. 化合物XZ3中各原子均满足8电子的稳定结构
B. X、Y、Z三种元素形成的含氧酸都是强酸
C. 常温下,Z单质可与Y的氢化物发生置换反应
D. 一定条件下,X2与Al反应得到AlX
【答案】B
【解析】分析:根据元素在周期表的相对位置可以得出,X是第二周期元素,Y、Z是第三周期元素。X通过共用三对电子形成X2分子,说明X的最外层有5个电子,属于第ⅤA,即X是氮元素,则Y、Z是S、Cl,结合元素周期律、物质的性质以及题干问题解答。
详解:根据以上分析可知X是N,Y是S,Z是Cl。则
A、在化合物NCl3中N和Cl的化合价分别是+3价和-1价,均满足8电子稳定结构,A正确;
B、只有这三种元素的最高价氧化物的水化物才是强酸,例如H2SO3是弱酸,B错误;
C、氯的非金属性强于硫,氯气能与硫化氢发生置换反应生成氯化氢和单质硫,C正确;
D、氮和铝都是活泼的非金属和金属,二者化合可以生成AlN,D正确。答案是B。

【题目】下表为八种短周期主族元素的部分性质(已知铍的原子半径为0.89×10-10m):
元素代号 | X | Y | Z | M | R | J | Q | T |
原子半径/10-10m | 0.74 | 0.75 | 0.99 | 1.86 | 1.43 | 1.10 | ||
主要化合价 | -2 | +5、-3 | +4、-4 | +7、-1 | +1 | +3 | +5、-3 | |
其它 | 原子核内无中子 | 无机非金属材料主角 | 有两种氧化物 |
(1)元素M在元素周期表中的位置为_________________________。
(2)写出X、Y、J三种元素形成的化合物电子式_________。用电子式表示X元素与Z元素形成化合物的过程:_______________________。
(3)写出Y与Q两种元素形成的化合物与J的最高价氧化物的水化物反应的离子方程式_____。
(4)R与T相比,非金属性较强的是____(用元素符号表示),下列事实能证明这一结论的是_______(填字母)。
A.常温下T的单质呈固态,R的单质呈气态
B.R的氢化物比T的氢化物稳定
C.R的氢化物水溶液酸性比T的氧化物对应水化物酸性强
D.R与T形成的化合物中T呈正价
(5)J与Q相比,金属性较强的是____(用元素符号表示),能证明这一结论的依据是______。
(6)根据表中数据推测,M的原子半径的最小范围是 ____________________。