题目内容
下列实验“操作和现象”与“结论”对应关系正确的是
| | 操作和现象 | 结论 |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| C | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| D | 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去 | 使溶液褪色的气体是乙烯 |
C
解析试题分析:A、产生红棕色气体是因为加入了硫酸后溶液中就有了硝酸,硝酸与亚铁离子发生反应,硝酸被还原为一氧化氮,一氧化氮与氧气结合生成了红棕色的二氧化氮的缘故,错误;B、葡萄糖与新制氢氧化铜浊液的反应是在碱性的环境下,淀粉水解后没中和原来的硫酸,导致没有红色沉淀产生,错误;C、碳酸氢钠的溶解度小于碳酸钠溶解度,所以向饱和的碳酸钠溶液中通二氧化碳产生碳酸氢钠会以固体形式析出,正确;D、乙醇与浓硫酸混合加热产生的气体除乙烯外还可能产生二氧化硫,二氧化硫也能使酸性高锰酸钾溶液褪色,所以使溶液褪色的不一定是乙烯,错误,答案选C。
考点:考查硝酸的强氧化性、醛基被氧化的环境、钠盐溶解度的比较、乙醇与浓硫酸共热的产物

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
根据下列实验现象得出的结论正确的是
| 选项 | 实验现象 | 结论 |
| A | 将BaSO4浸泡在宝盒Na2CO3溶液中,部分BaSO4转化为BaCO3 | Ksp(BaSO4)>Ksp(BaCO3) |
| B | 某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成 | 该溶液中一定存在SO42- |
| C | 滴有酚酞的Na2CO3溶液中加入BaCl2固体,红色变浅 | Na2CO3溶液中存在水解平衡 |
| D | 溴水中通入SO2,溴水褪色 | SO2具有漂白性 |
现有H2SO4、Ba(OH)2、Na2CO3和氯水四种溶液,有如图所示的相互关系,下图中每条线段两端的物质可以发生化学反应。下列推断合理的是( )。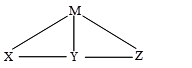
| A.M一定是Ba(OH)2 | B.Y可能是氯水 |
| C.X一定是Na2CO3溶液 | D.Z可能是H2SO4 |
除去下列物质中所含的杂质。选用的试剂正确的是( )
| 选项 | 物质(杂质) | 试剂 |
| A | Al2O3(SiO2) | NaOH溶液 |
| B | CO2(SO2) | Na2CO3溶液 |
| C | FeCl2溶液(FeCl3) | Fe粉 |
| D | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 |
下表所列各组物质中,物质之间通过一步反应就能实现如下图所示转化的是 ( )
| 编号 | 物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| ① | 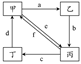 | Cu | CuO | CuCl2 | Cu(NO3)2 |
| ② | Na2CO3 | NaOH | NaHCO3 | CO2 | |
| ③ | (NH4)2SO3 | CaSO3 | SO2 | NH4HSO3 | |
| ④ | Al(OH)3 | Al2O3 | Na[Al(OH)4] 或NaAlO2 | AlCl3 |
A.①②③④ B.①②③ C.①③④ D.②④
下列化学实验事实及其解释都正确的是( )
| A.向KMnO4溶液中滴加盐酸,KMnO4溶液的氧化能力增强。说明盐酸具有氧化性 |
| B.向澄清的AlCl3稀溶液中加入NaOH浓溶液,振荡,溶液仍为澄清。说明该两种溶液混合是物理变化 |
| C.向FeCl3溶液中加入过量Cu粉,振荡、静置,溶液由黄色变为绿色。说明Fe3+具有氧化性 |
| D.向CaCl2溶液中通入CO2,不产生白色沉淀。说明CaCO3能溶于水 |
下列有关物质的性质或应用的说法不正确的是( )。
| A.二氧化硅是生产光纤制品的基本原料 |
| B.水玻璃可用于生产黏合剂和防火剂 |
| C.盐析可提纯蛋白质并保持其生理活性 |
| D.石油分馏可获得乙烯、丙烯和丁二烯 |
海洋中有丰富的食品、矿产、能源、药物和水产资源。下图是从海水中提取某些原料的流程图。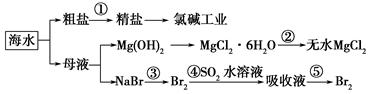
下列有关说法正确的是( )。
| A.第①步中除去粗盐中的SO42—、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液―→NaOH溶液―→BaCl2溶液―→过滤后加盐酸 |
| B.工业上通过氯碱工业制取金属钠 |
| C.从第③步到第⑤步的目的是浓缩、富集溴单质 |
| D.第②步的反应条件是高温加热 |
下列关于海水知识的叙述中不正确的是( )
| A.海水资源的利用包括海水水资源的利用和海水化学资源的利用 |
| B.海水既苦又涩,不能直接利用 |
| C.海水中某些金属元素总储量大,但富集程度却很低 |
| D.海水淡化应同化工生产、能源技术结合 |