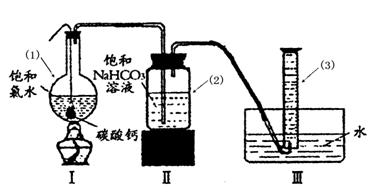
题目内容
新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2,请设计实验证明有O2生成. .
(2)氯气能使湿润的红色布条褪色.对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能.请你设计实验,得出正确结论.
(3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大.
H2CO3?HCO3-+H+ Ka1(H2CO3)=4.45×10-7
HCO3-?CO32-+H+ Ka2(HCO3-)=5.61×10-11
HClO?H++ClO- Ka(HClO)=2.95×10-8
请依据以上电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通入到过量的碳酸钠溶液中;
②氯气和碳酸钠按照1:1的比例恰好反应;
③将过量的氯气通入到少量的碳酸钠溶液中. .
(1)HClO不稳定,见光易分解生成HCl和O2,请设计实验证明有O2生成.
(2)氯气能使湿润的红色布条褪色.对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能.请你设计实验,得出正确结论.
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
| 氯水中何种物质能使湿润的红色布条褪色 | ①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 |
① ② ③ ④H2O使布条褪色 |
实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色 实验②: 实验③: 实验④:把红色布条放在水里布条不褪色 |
H2CO3?HCO3-+H+ Ka1(H2CO3)=4.45×10-7
HCO3-?CO32-+H+ Ka2(HCO3-)=5.61×10-11
HClO?H++ClO- Ka(HClO)=2.95×10-8
请依据以上电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通入到过量的碳酸钠溶液中;
②氯气和碳酸钠按照1:1的比例恰好反应;
③将过量的氯气通入到少量的碳酸钠溶液中.
分析:(1)次氯酸见光分解生成氧气和盐酸,氧气能使带火星的木条复燃;
(2)根据氯水的成分进行假设,氯水中含有氯气、次氯酸、盐酸和水,然后依次进行假设;利用对比实验验证假设,根据实验现象作出判断,从而得出结论;
(3)依据电离平衡常数判断出的酸性H2CO3 >HClO>HCO3-;依据酸性强弱分析反应产物.
(2)根据氯水的成分进行假设,氯水中含有氯气、次氯酸、盐酸和水,然后依次进行假设;利用对比实验验证假设,根据实验现象作出判断,从而得出结论;
(3)依据电离平衡常数判断出的酸性H2CO3 >HClO>HCO3-;依据酸性强弱分析反应产物.
解答:解:(1)次氯酸不稳定,见光易分解生成氧气,将盛满氯水的无色塑料瓶导致在水槽中,光照一段时间后,会看到有气泡产生,将瓶子倒转过量,用带火星的木条插入瓶口检验气体,如果木条复燃,说明次氯分解产生的气体是氧气,
故答案为:将盛满氯水的无色塑料瓶倒置在水槽中,光照一段时间后,有无色气体生成,将瓶子倒转过来,用带火星的木条插入瓶口检验气体,若木条复燃,证明HClO分解生成的气体为氧气;
(2)[提出假设]氯气溶于水发生反应Cl2+H2O?HCl+HClO,根据方程式知,溶液中的成分是氯气、水、盐酸和次氯酸,根据氯水中的成分进行假设:
①氯气使布条褪色;
②HClO使布条褪色;
③盐酸使布条褪色;
[验证假设]
②把红色布条伸入氯水中,红色布条褪色;
③把红色布条伸入稀盐酸中,红色布条不褪色;
[得出结论]利用对比实验知,只有加入氯水中的有色布条褪色,从而得出结论为:次氯酸使有色布条褪色,
故答案为:氯气使布条褪色;次氯酸使布条褪色;盐酸使布条褪色;
把红色布条伸入氯水中,红色布条褪色;把红色布条伸入稀盐酸中,红色布条不褪色;
次氯酸使布条褪色.
(3)①将少量的氯气通入到过量的碳酸钠溶液中,氯气和水反应生成的盐酸反应生成碳酸氢钠,次氯酸酸性强于碳酸氢根离子,反应生成碳酸氢钠,反应的离子方程式为:Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-,
故答案为:Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-;
②氯气和碳酸钠按照1:1的比例恰好反应,生成的盐酸恰好和碳酸钠反应生成碳酸氢钠,次氯酸不参与反应,反应的离子方程式为:Cl2+CO32-+H2O═HCO3-+Cl-+HClO,
故答案为:Cl2+CO32-+H2O═HCO3-+Cl-+HClO;
③将过量的氯气通入到少量的碳酸钠溶液中,盐酸过量和碳酸钠反应生成二氧化碳,次氯酸和碳酸钠反应生成碳酸氢钠,反应的离子方程式为:2Cl2+CO32-+H2O═CO2↑+2Cl-+2HClO,
故答案为:2Cl2+CO32-+H2O═CO2↑+2Cl-+2HClO.
故答案为:将盛满氯水的无色塑料瓶倒置在水槽中,光照一段时间后,有无色气体生成,将瓶子倒转过来,用带火星的木条插入瓶口检验气体,若木条复燃,证明HClO分解生成的气体为氧气;
(2)[提出假设]氯气溶于水发生反应Cl2+H2O?HCl+HClO,根据方程式知,溶液中的成分是氯气、水、盐酸和次氯酸,根据氯水中的成分进行假设:
①氯气使布条褪色;
②HClO使布条褪色;
③盐酸使布条褪色;
[验证假设]
②把红色布条伸入氯水中,红色布条褪色;
③把红色布条伸入稀盐酸中,红色布条不褪色;
[得出结论]利用对比实验知,只有加入氯水中的有色布条褪色,从而得出结论为:次氯酸使有色布条褪色,
故答案为:氯气使布条褪色;次氯酸使布条褪色;盐酸使布条褪色;
把红色布条伸入氯水中,红色布条褪色;把红色布条伸入稀盐酸中,红色布条不褪色;
次氯酸使布条褪色.
(3)①将少量的氯气通入到过量的碳酸钠溶液中,氯气和水反应生成的盐酸反应生成碳酸氢钠,次氯酸酸性强于碳酸氢根离子,反应生成碳酸氢钠,反应的离子方程式为:Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-,
故答案为:Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-;
②氯气和碳酸钠按照1:1的比例恰好反应,生成的盐酸恰好和碳酸钠反应生成碳酸氢钠,次氯酸不参与反应,反应的离子方程式为:Cl2+CO32-+H2O═HCO3-+Cl-+HClO,
故答案为:Cl2+CO32-+H2O═HCO3-+Cl-+HClO;
③将过量的氯气通入到少量的碳酸钠溶液中,盐酸过量和碳酸钠反应生成二氧化碳,次氯酸和碳酸钠反应生成碳酸氢钠,反应的离子方程式为:2Cl2+CO32-+H2O═CO2↑+2Cl-+2HClO,
故答案为:2Cl2+CO32-+H2O═CO2↑+2Cl-+2HClO.
点评:本题考查了实验探究,根据混合物中的成分进行假设,结合实验验证假设,根据对比实验中不同现象得出结论,反应量不同产物不同,注意电离平衡常数的分析应用,难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
 ②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;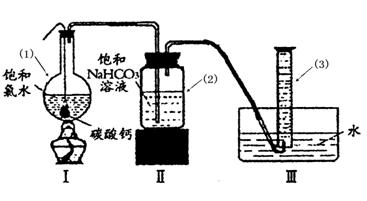
 越大。
越大。
 + H+ Ka1(H2CO3)=4.45×10—7
+ H+ Ka1(H2CO3)=4.45×10—7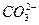 +H+ Ka2(HCO3-)=5.61×10-11
+H+ Ka2(HCO3-)=5.61×10-11 Ka(HClO)=2.95×10-8
Ka(HClO)=2.95×10-8
 面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。