��Ŀ����
����Ŀ����һ����֪2A2��g����B2��g��![]() 2C3��g������H ����a kJ/mol��a��0������һ���д����Ĺ̶��ݻ��������м���2 mol A2��1 mol B2����500 ��ʱ��ַ�Ӧ��ƽ��ʱ�ų�����b kJ��
2C3��g������H ����a kJ/mol��a��0������һ���д����Ĺ̶��ݻ��������м���2 mol A2��1 mol B2����500 ��ʱ��ַ�Ӧ��ƽ��ʱ�ų�����b kJ��
��1���Ƚ�a___b��������������������
��2��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����__________��
A����ʱ�����C3���� B���ʵ������¶�
C������B2��Ũ�� D��ѡ���Ч�Ĵ���
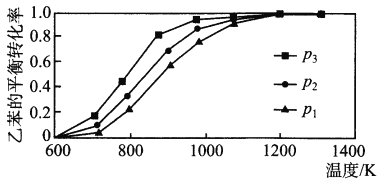
��3����ͼ��ʾ�˷�Ӧ�ķ�Ӧ����v��ʱ��t�Ĺ�ϵͼ��������ͼ�жϣ���t1��t4ʱ�̸ı����������ֱ���_______________�� _____________ ��
��������һ�ݻ�Ϊ2L���ܱ������У�����0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��N2(g)+3H2(g)![]() 2NH3(g)����H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺
2NH3(g)����H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺
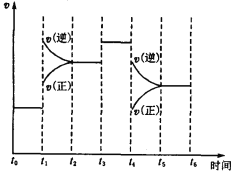
��1��������ͼ���÷�Ӧ�ﵽƽ��ʱH2��ת���ʵ���__________��
��2����5����ĩ�����������������䣬���ı䷴Ӧ�¶ȣ�����ƽ���NH3�����ʵ���Ũ�Ȳ�����Ϊ_________��������ţ���
a 0.20mol��L-1 b 0.12 mol��L-1 c 0.10 mol��L-1 d 0.08 mol��L-1
��3�����ڵ�5����ĩ�������������Сһ����ڵ�8���Ӵﵽ�µ�ƽ�⣨��ʱNH3��Ũ��ԼΪ0.25 mol��L-1 ����������ͼ�л�����5���ӵ�9����NH3Ũ�ȵı仯���ߡ�____________
���𰸡���C�����¶Ƚ���ѹǿ50%a��c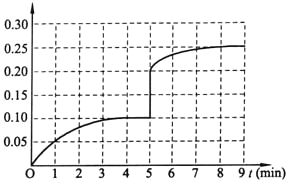
��������
(һ)(1)�Ȼ�ѧ����ʽ���������Ϊ����2mol A2��1mol B2��ȫ��Ӧʱ���ų�����ΪakJ��������2mol A2��1mol B2�ﵽƽ��ʱ��û����ȫ��Ӧ�����ͷŵ�����С����ȫ��Ӧ�ͷŵ���������a��b���ʴ�Ϊ������
(2)A����ʱ�����C3���壬ƽ�������ƶ�������Ӧ���ʼ�С���ʴ���B���ʵ������¶ȷ�Ӧ��������ƽ�������ƶ����ʴ���C������B2��Ũ�ȣ�ƽ�������ƶ��ҷ�Ӧ����������ȷ��D��ѡ���Ч�Ĵ�������Ӧ��������ƽ�ⲻ�ƶ����ʴ���ѡC��
(3)��2A2(g)��B2(g)![]() 2C3(g)����H ����a kJ/mol(a��0)����֪���÷�ӦΪ���ȷ�Ӧ����Ϊ���������С�ķ�Ӧ������ͼ��֪��t1���淴Ӧ���ʾ��������淴Ӧ���ʴ�������Ӧ���ʣ��ı�����ӦΪ�����¶ȣ�t4ʱ���淴Ӧ���ʾ���С�����淴Ӧ���ʴ�������Ӧ���ʣ��ı�����ӦΪ����ѹǿ���ʴ�Ϊ�������¶ȣ�����ѹǿ��
2C3(g)����H ����a kJ/mol(a��0)����֪���÷�ӦΪ���ȷ�Ӧ����Ϊ���������С�ķ�Ӧ������ͼ��֪��t1���淴Ӧ���ʾ��������淴Ӧ���ʴ�������Ӧ���ʣ��ı�����ӦΪ�����¶ȣ�t4ʱ���淴Ӧ���ʾ���С�����淴Ӧ���ʴ�������Ӧ���ʣ��ı�����ӦΪ����ѹǿ���ʴ�Ϊ�������¶ȣ�����ѹǿ��
(��)(1)��c(NH3)=0.1mol/L��Ũ�ȱ仯��֮�ȵ��ڻ�ѧ������֮�ȣ�������c(H2)=![]() ��c(NH3)=
��c(NH3)=![]() ��0.1mol/L=0.15mol/L���ʲμӷ�Ӧ�����������ʵ���Ϊ0.15mol/L��2L=0.3mol������������ת����Ϊ
��0.1mol/L=0.15mol/L���ʲμӷ�Ӧ�����������ʵ���Ϊ0.15mol/L��2L=0.3mol������������ת����Ϊ![]() ��100%=50%���ʴ�Ϊ��50%��
��100%=50%���ʴ�Ϊ��50%��
(2)�÷�ӦΪ���淴Ӧ����Ӧ�ﲻ������ȫת������NH3�����ʵ���Ũ�Ȳ�����Ϊ0.2mol/L���¶ȸı�ƽ��һ�������ƶ�����NH3�����ʵ���Ũ�Ȳ�����Ϊ0.1mol/L���ʴ�Ϊ��a��c��
(3)��5����ĩ�������������Сһ���˲�䰱��Ũ��Ϊ0.20mol/L��ѹǿ����ƽ�������ƶ���������Ũ�������ڵ�8����ĩ�ﵽ�µ�ƽ��ʱNH3��Ũ��ԼΪ0.25molL-1����5����ĩ��ƽ��ʱNH3Ũ�ȵı仯����ͼ��Ϊ��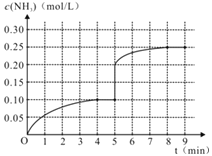 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��

����Ŀ������ʵ�鷽����������(����)
|
|
|
|
A.��ȡ����CO2,���濪����,�����ͣ | B.����һ�����ʵ���Ũ�ȵ�ϡ���� | C.���Ƶ�Fe(OH)2,���۲�����ɫ | D. ����ռ�NH3,�����ն����β�� |
A. AB. BC. CD. D
����Ŀ����֪2A(g)��B(g)![]() 2C(g)����H����a kJ��mol��1(a>0)����һ���д����Ĺ̶��ݻ��������м���2 mol A��1 mol B����500 ��ʱ��ַ�Ӧ��ƽ���C��Ũ��Ϊ�� mol��L��1���ų�������Ϊb kJ��
2C(g)����H����a kJ��mol��1(a>0)����һ���д����Ĺ̶��ݻ��������м���2 mol A��1 mol B����500 ��ʱ��ַ�Ӧ��ƽ���C��Ũ��Ϊ�� mol��L��1���ų�������Ϊb kJ��
��1����֪��A(g)��X(g)![]() 2B(g)����H����133.2 kJ��mol��1��
2B(g)����H����133.2 kJ��mol��1��
5A(g)��X(g)![]() 4C(g)����H����650.4 kJ��mol��1����a��________��
4C(g)����H����650.4 kJ��mol��1����a��________��
��2����ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�������ʾ���ɴ˿���֪������T1________T2(����>������������<��)��
T/K | T1 | T2 | T3 |
K | 6.86 | 2.45 | 1.88 |
��3����������������Ϊ��ѹ����(��Ӧǰ�����ͬ)����ʼʱ����2 mol A��1 mol B��500 ��ʱ��ַ�Ӧ��ƽ��ų�������Ϊd kJ����d________b(����>������������<��)��
��4����һ���¶��£���һ���ݻ��ɱ�ĺ�ѹ�����У�ͨ��3 mol A��2 mol B��������Ӧ2A(g)��B(g)![]() 2C(g)��ƽ��ʱ�������������ʵ���Ϊ��ʼʱ��80%������ͬһ��Ӧ�¶ȣ�����ͬ�����У�����ʼͶ������Ϊ6 mol A��4 mol B����ƽ��ʱA���������Ϊ________��
2C(g)��ƽ��ʱ�������������ʵ���Ϊ��ʼʱ��80%������ͬһ��Ӧ�¶ȣ�����ͬ�����У�����ʼͶ������Ϊ6 mol A��4 mol B����ƽ��ʱA���������Ϊ________��