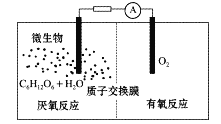
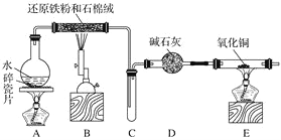
ЬтФПФкШн
ЁОЬтФПЁПгавЛКЌNaClЁЂNa2CO3ЁЄ10H2OКЭNaHCO3ЕФЛьКЯЮяЃЌФГЭЌбЇЩшМЦШчЭМЫљЪОЕФЪЕбщзАжУЃЌЭЈЙ§ВтСПЗДгІВњЩњЕФCO2КЭH2OЕФжЪСПЃЌРДШЗЖЈИУЛьКЯЮяжаИїзщЗжЕФжЪСПЗжЪ§ЁЃЃЈМюЪЏЛвЪЧЧтбѕЛЏФЦКЭбѕЛЏИЦЕФЛьКЯЮяЃЉ

ЃЈ1ЃЉЪЕбщВНжшЃК
ЂйАДЭМ(МаГжвЧЦїЮДЛГі)зщзАКУЪЕбщзАжУКѓЃЌЪзЯШНјааЕФВйзїЪЧ________________ЁЃ
ЂкГЦШЁбљЦЗЃЌВЂНЋЦфЗХШыгВжЪВЃСЇЙмжаЃЛГЦСПзАХЈСђЫсЕФЯДЦјЦПCЕФжЪСПКЭзАМюЪЏЛвЕФUаЮЙмDЕФжЪСПЁЃ
ЂлДђПЊЛюШћK1ЁЂK2ЃЌЙиБеK3ЃЌЛКЛКЙФШыПеЦјЪ§ЗжжгЃЌЦфФПЕФЪЧГ§ШЅзАжУжаЕФЫЎеєЦјКЭЖўбѕЛЏЬМЁЃ
ЂмЙиБеЛюШћK1ЁЂK2ЃЌДђПЊK3ЃЌЕуШМОЦОЋЕЦМгШШжСВЛдйВњЩњЦјЬхЁЃзАжУBжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ____________________________ЁЂ__________________________ЁЃ
ЂнДђПЊЛюШћK1ЃЌЛКЛКЙФШыПеЦјЪ§ЗжжгЃЌШЛКѓВ№ЯТзАжУЃЌдйДЮГЦСПЯДЦјЦПCЕФжЪСПКЭUаЮЙмDЕФжЪСПЁЃ
ЃЈ2ЃЉЙигкИУЪЕбщЗНАИЃЌЧыЛиД№ЯТСаЮЪЬтЁЃ
ЂйШєМгШШЗДгІКѓВЛЙФШыПеЦјЃЌЖдВтЖЈНсЙћЕФгАЯьЪЧ_______________________________ЁЃ
ЂкEДІИЩдяЙмжаЪЂЗХЕФвЉЦЗЪЧ________ЃЌЦфзїгУЪЧ________________________ЃЌШчЙћЪЕбщжаУЛгаИУзАжУЃЌдђЛсЕМжТВтСПНсЙћNaHCO3ЕФжЪСПЗжЪ§______________(ЬюЁАЦЋДѓЁБЁАЦЋаЁЁБЛђЁАЮогАЯьЁБ)ЁЃ
ЂлШєбљЦЗжЪСПЮЊw gЃЌЗДгІКѓCЁЂDзАжУдіМгЕФжЪСПЗжБ№ЮЊm1 gЁЂm2 gЃЌдђЛьКЯЮяжаNa2CO3ЁЄ10H2OЕФжЪСПЗжЪ§ЮЊ________(гУКЌwЁЂm1ЁЂm2ЕФДњЪ§ЪНБэЪО)ЁЃ
ЁОД№АИЁПМьВщзАжУЦјУмад 2NaHCO3![]() Na2CO3ЃЋH2OЁќЃЋCO2Ёќ Na2CO3ЁЄ10H2O
Na2CO3ЃЋH2OЁќЃЋCO2Ёќ Na2CO3ЁЄ10H2O![]() Na2CO3ЃЋ10H2OЁќ Na2CO3ЁЄ10H2OКЭNaHCO3ЕФжЪСПЗжЪ§ВтЖЈНсЙћЦЋаЁЃЌNaClЕФжЪСПЗжЪ§ВтЖЈНсЙћЦЋДѓ МюЪЏЛв ЗРжЙПеЦјжаЕФCO2КЭЫЎеєЦјНјШыDжагАЯьВтЖЈНсЙћ ЦЋДѓ
Na2CO3ЃЋ10H2OЁќ Na2CO3ЁЄ10H2OКЭNaHCO3ЕФжЪСПЗжЪ§ВтЖЈНсЙћЦЋаЁЃЌNaClЕФжЪСПЗжЪ§ВтЖЈНсЙћЦЋДѓ МюЪЏЛв ЗРжЙПеЦјжаЕФCO2КЭЫЎеєЦјНјШыDжагАЯьВтЖЈНсЙћ ЦЋДѓ ![]() ЁС100%
ЁС100%
ЁОНтЮіЁП
НЋЛьКЯЮяМгШШЛсВњЩњH2O(g)ЁЂCO2ЕШЦјЬхЃЌгІдкCЁЂDжаЗжБ№ЮќЪеЃЌгЩИЩдяМСЕФаджЪжЊгІЯШЮќЪеЫЎЃЌдйЮќЪеЖўбѕЛЏЬМЃЌМДCжаЕФИЩдяМСЮќЫЎКѓВЛФмЮќЪеCO2ЃЛгЩDЕФдіжиЃЈNaHCO3ЗжНтВњЩњЕФCO2ЕФжЪСПЃЉПЩЧѓГіNaHCO3жЪСПЃЛгЩCЕФдіжиЃЈNa2CO310H2OЗжНтВњЩњЕФH2OМАвбОжЊЕРЕФNaHCO3ЗжНтВњЩњЕФH2OЕФжЪСПЃЉПЩЧѓГіNa2CO310H2OЕФжЪСПЃЌДгЖјМфНгЧѓГіNaClЕФжЪСПЃЛЙЪгІдкЪЕбщЧАЯыЗЈИЯГізАжУжаЕФПеЦјЃЌЙиМќВйзїгІЪЧИЩдяВЂГ§ОЁBжаЕФПеЦјЃЌЫљвдДђПЊЛюШћK1ЁЂK2ЃЌЙиБеK3ОЭГЩЮЊВйзїЕФЙиМќЃЛEжаМюЪЏЛвПЩЗРжЙЭтНчПеЦјжаЕФH2O(g)ЁЂCO2НјШызАжУDгАЯьЪЕбщаЇЙћЃЌ
ЃЈ1ЃЉЂйИљОнЪЕбщЛљБОВйзїВНжшПЩжЊЃЌЦјЬхЗЂЩњзАжУашвЊМьВщзАжУЦјУмадЃЛ
ЂмКЌNaClЁЂNa2CO310H2OКЭNaHCO3ЕФЛьКЯЮяМгШШЪБЃЌЬМЫсЧтФЦЗжНтЩњГЩЬМЫсФЦЁЂЖўбѕЛЏЬМКЭЫЎЃЌЬМЫсФЦОЇЬхЪЇШЅНсОЇЫЎЩњГЩЬМЫсФЦЃЛ
ЃЈ2ЃЉЂйШєМгШШЗДгІКѓВЛЙФШыПеЦјЃЌЩњГЩЫЎеєЦјжЪСПКЭЖўбѕЛЏЬМжЪСПВтЖЈНсЙћЛсМѕаЁЃЛ
ЂкEДІИЩдяЙмЪЧМюЪЏЛвЃЌЗРжЙПеЦјжаЫЎеєЦјКЭЖўбѕЛЏЬМНјШызАжУDгАЯьВтЖЈНсЙћЃЌШчЙћЪЕбщжаУЛгаИУзАжУDзАжУжаВтЖЈЖўбѕЛЏЬМжЪСПдіДѓЃЛ
ЂлИљОнDзАжУжадіжижЪСПМЦЫуЮќЪеЕФЖўбѕЛЏЬМЕФСПЃЌИљОнЬМЫсЧтФЦЗжНтЪБЩњГЩЕФЖўбѕЛЏЬМКЭЫЎеєЦјЕФЙиЯЕЪНМЦЫуЬМЫсЧтФЦЩњГЩЕФЫЎеєЦјЃЌзмЕФЫЎеєЦјМѕШЅЬМЫсЧтФЦЩњГЩЕФЫЎеєЦјОЭЪЧЪЎЫЎЬМЫсФЦЗжНтЩњГЩЕФЫЎеєЦјЃЌИљОнЪЎЫЎЬМЫсФЦЗжНтЩњГЩЕФЫЎеєЦјКЭЪЎЫЎЬМЫсФЦЕФЙиЯЕЪНМЦЫуЪЎЫЎЬМЫсФЦЕФжЪСПЃЌДгЖјМЦЫуЦфжЪСПЗжЪ§ЁЃ
ЃЈ1ЃЉЂйЮЊЪЙЪЕбщЫГРћНјааЃЌЦјЬхЗЂЩњзАжУзщзАКУвЧЦїКѓЃЌЪзЯШашвЊНјааМьВщзАжУЦјУмадВйзїЃЌ
ЙЪД№АИЮЊЃКМьВщзАжУЦјУмадЃЛ
ЂмКЌNaClЁЂNa2CO310H2OКЭNaHCO3ЕФЛьКЯЮяМгШШЪБЃЌЬМЫсЧтФЦЗжНтЩњГЩЬМЫсФЦЁЂЖўбѕЛЏЬМКЭЫЎЃЌгыДЫЭЌЪБЃЌЬМЫсФЦОЇЬхВЛЮШЖЈЃЌЛсЪЇШЅНсОЇЫЎЩњГЩЬМЫсФЦЃЌЦїЛЏбЇЗНГЬЪНЗжБ№ЮЊЃК2NaHCO3![]() Na2CO3ЃЋH2OЁќЃЋCO2ЁќЃЛNa2CO3ЁЄ10H2O
Na2CO3ЃЋH2OЁќЃЋCO2ЁќЃЛNa2CO3ЁЄ10H2O![]() Na2CO3ЃЋ10H2OЁќЃЌ
Na2CO3ЃЋ10H2OЁќЃЌ
ЙЪД№АИЮЊЃК2NaHCO3![]() Na2CO3ЃЋH2OЁќЃЋCO2ЁќЃЛNa2CO3ЁЄ10H2O
Na2CO3ЃЋH2OЁќЃЋCO2ЁќЃЛNa2CO3ЁЄ10H2O![]() Na2CO3ЃЋ10H2OЁќЃЛ
Na2CO3ЃЋ10H2OЁќЃЛ
ЃЈ2ЃЉЂйШєМгШШЗДгІКѓВЛЙФШыПеЦјЃЌЩњГЩЫЎеєЦјжЪСПКЭЖўбѕЛЏЬМжЪСПВтЖЈНсЙћЛсМѕаЁЃЌЬМЫсЧтФЦвРОнЖўбѕЛЏЬММЦЫуЃЌЖјNa2CO310H2OЕФВтЖЈЪЧИљОнЩњГЩЫЎЕФзмжЪСПМЦЫуЕФЃЌдђВтЕУNa2CO310H2OЕФКЌСПНЋЦЋаЁЃЌЖдВтЖЈНсЙћЕФгАЯьЪЧNaClЦЋДѓЃЌNaHCO3ЦЋаЁЃЌNa2CO310H2OЦЋаЁЃЌ
ЙЪД№АИЮЊЃКNa2CO3ЁЄ10H2OКЭNaHCO3ЕФжЪСПЗжЪ§ВтЖЈНсЙћЦЋаЁЃЌNaClЕФжЪСПЗжЪ§ВтЖЈНсЙћЦЋДѓЃЛ
ЂкИЩдяЙмжаЪЂЗХЕФЪЧМюЪЏЛвЃЌМюЪЏЛвФмЮќЪеПеЦјжаЕФЫЎеєЦјКЭЖўбѕЛЏЬМЃЌЫљвдИЩдяЙмЕФзїгУЪЧЗРжЙПеЦјжаЕФCO2КЭЫЎеєЦјНјШыгАЯьВтЖЈНсЙћЃЌШєГЗШЅEзАжУЃЌдђDзАжУЕФдіжиЦЋДѓЃЌЕМжТВтЖЈНсЙћжаЬМЫсЧтФЦЕФжЪСПЦЋДѓЃЌ
ЙЪД№АИЮЊЃКМюЪЏЛвЃЛЗРжЙПеЦјжаЕФCO2КЭЫЎеєЦјНјШыDжагАЯьВтЖЈНсЙћЃЛЦЋДѓЃЛ
ЂлШєбљЦЗжЪСПЮЊw gЃЌЗДгІКѓCКЭDзАжУдіМгЕФжЪСПЗжБ№ЮЊm1 gЁЂm2 gЃЌDзАжУжадіМгЕФжЪСПЮЊЖўбѕЛЏЬМЕФжЪСПЃЌЬМЫсЧтФЦЗжНтЩњГЩЕФЫЎеєЦјЕФжЪСПЮЊxЁЃ
2NaHCO3![]() Na2CO3ЃЋH2OЁќЃЋCO2Ёќ
Na2CO3ЃЋH2OЁќЃЋCO2Ёќ
18 44
x m2 g
дђx =![]() ЃЌ
ЃЌ
зАжУCЮќЪеЕФЪЧЫЎеєЦј,АќРЈЬМЫсЧтФЦЗжНтЩњГЩЕФКЭЪЎЫЎЬМЫсФЦЗжНтЩњГЩЕФСНВПЗжЃЌЪЎЫЎЬМЫсФЦЗжНтЩњГЩЕФЫЎеєЦјЕФжЪСП=ЃЈm1 ![]() ЃЉgЃЌ
ЃЉgЃЌ
ЩшЪЎЫЎЬМЫсФЦЕФжЪСПЮЊyЁЃ
Na2CO3ЁЄ10H2O![]() Na2CO3ЃЋ10H2OЁќ
Na2CO3ЃЋ10H2OЁќ
286 10![]() 18
18
y ЃЈm1 ![]() ЃЉg
ЃЉg
y= ![]() g
g
ЫљвдЪЎЫЎЬМЫсФЦЕФжЪСПЗжЪ§ = ![]() ЁС100%ЃЌ
ЁС100%ЃЌ
ЙЪД№АИЮЊЃК![]() ЁС100%ЃЛ
ЁС100%ЃЛ

 ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ
ЬьЬьЯђЩЯвЛБОКУОэЯЕСаД№АИ аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИ
аЁбЇЩњ10ЗжжггІгУЬтЯЕСаД№АИЁОЬтФПЁПЯТБэжаЙигкЮяжЪЗжРрЕФе§ШЗзщКЯЪЧ ЃЈ ЃЉ
РрБ№зщКЯ | ЫсадбѕЛЏЮя | МюадбѕЛЏЮя | Ыс | Мю | бЮ |
A | CO2 | CuO | H2SO4 | NH3ЁЄH2O | Na2S |
B | CO | Na2O | HCl | NaOH | NaCl |
C | SO2 | Na2O2 | CH3COOH | KOH | CaF2 |
D | NO2 | CaO | HNO3 | Cu(OH)2CO3 | CaCO3 |
A.A
B.B
C.C
D.D
ЁОЬтФПЁПЃЈ8Зж)ФГаЃЛЏбЇПЮЭтаЁзщЮЊСЫМјБ№ЬМЫсФЦКЭЬМЫсЧтФЦСНжжАзЩЋЙЬЬхЃЌгУВЛЭЌЕФЗНЗЈзіСЫвдЯТЪЕбщЃЌШчЭМЫљЪОЁЃ
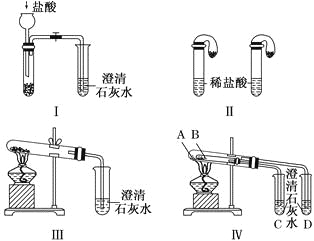
ЃЈ1ЃЉжЛИљОнЭМЂёЁЂЂђЫљЪОЪЕбщЃЌФмЙЛДяЕНЪЕбщФПЕФЕФЪЧ________(ЬюзАжУађКХ)ЁЃ
ЃЈ2ЃЉЭМЂѓЁЂЂєЫљЪОЪЕбщОљФмМјБ№етСНжжЮяжЪЃЌЦфЗДгІЕФЛЏбЇЗНГЬЪНЃК__________________ЃЛ
гыЪЕбщЂѓЯрБШЃЌЪЕбщЂєЕФгХЕуЪЧ__________(ЬюбЁЯюађКХ)ЁЃ
AЃЎЂєБШЂѓИДдг |
BЃЎЂєБШЂѓАВШЋ |
CЃЎЂєБШЂѓВйзїМђБу |
DЃЎЂєПЩвдзіЕНгУвЛЬззАжУЭЌЪБНјааСНИіЖдБШЪЕбщЃЌЖјЂѓВЛаа |
ЃЈ3ЃЉШєгУЪЕбщЂєбщжЄЬМЫсФЦКЭЬМЫсЧтФЦЕФЮШЖЈадЃЌдђЪдЙмBжазАШыЕФЙЬЬхзюКУЪЧ________(ЬюЛЏбЇЪН)ЁЃ