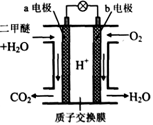
题目内容
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是 ( )
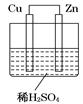
A.①②③ B.②③④ C.②④ D.③④⑤

| 实验后的记录: ①Cu为负极,Zn为正极 ②Cu极上有气泡产生,发生还原反应 ③ 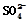 向Cu极移动 向Cu极移动④若有0.5mol电子流经导线,则可产生0.25mol气体 ⑤电子的流向是:Cu―→Zn ⑥正极反应式:Cu—2e-===Cu2+,发生氧化反应 |
C
试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。因此再Zn-Cu原电池中,Zn作负极,发生电池反应Zn+2H+=Zn2++H2↑,电子由负极流向正极,阳离子向正极移动。
Zn为负极,Cu为正极,故①错误;H+向正极移动,在铜电极上得到电子,放出氢气,故②正确;SO42-向负极锌电极移动,所以选项③错误;Cu电极上发生2H++2e-=H2↑,故⑥不正确;若有0.5mol电子流向导线,则产生氢气0.25mol,故④正确;电子由Zn电极流向Cu电极,故⑤不正确,答案选C。
点评:该题是高考种的常见题型和重要的考点,主要是考查学生对原电池原理、电极名称、电极反应式的了解掌握情况,旨在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是明确原电池的工作原理,电极的判断、发生的电极反应、电子、离子的移动方向,然后结合题意灵活运用即可。

练习册系列答案
相关题目