题目内容
1.短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是最外层电子数的2.5倍.下列说法不正确的是( )| A. | WX2分子中所有原子最外层都为8电子结构 | |
| B. | WX2、ZX2均为酸性氧化物 | |
| C. | WX2是以极性键结合成的非极性分子 | |
| D. | 最简单氢化物的稳定性:W>X |
分析 短周期元素W、X、Y、Z的原子序数依次增大,Y原子的内层电子总数是最外层电子数的2.5倍,则原子只能有3个电子层,最外层电子数为4,故Y为Si,W与Y同主族,则W为C元素,W与X可形成共价化合物WX2,则X表现-2价,X与Z位于同一主族,故X为O元素、Z为S元素,据此解答.
解答 解:短周期元素W、X、Y、Z的原子序数依次增大,Y原子的内层电子总数是最外层电子数的2.5倍,则原子只能有3个电子层,最外层电子数为4,故Y为Si,W与Y同主族,则W为C元素,W与X可形成共价化合物WX2,则X表现-2价,X与Z位于同一主族,故X为O元素、Z为S元素.
A.CO2分子中C原子与氧原子之间形成2对共用电子对,所有原子最外层都为8电子结构,故A正确;
B.CO2、SO2均为酸性氧化物,故B正确;
C.CO2分子中C、O原子之间形成极性键,CO2是直线型结构,属于非极性分子,故C正确;
D.由于非金属性W(C)<X(O),故氢化物稳定性W<X,故D错误,
故选:D.
点评 本题考查位置结构性质关系应用,Y的结构特点是推断突破口,注意对基础知识的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列离子方程式中不正确的是( )
| A. | 将盐酸加入稀氨水中 H++NH3•H2O═NH4++H2O | |
| B. | 以酚酞为指示剂用标准盐酸滴定苏打溶液CO32-+2H+═CO2↑+H2O | |
| C. | 氯化铝溶液与氢氧化钠溶液混合后,铝元素有一半转化为偏铝酸钠2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| D. | 用氯气与石灰浆生产漂白粉 Ca(OH)2+Cl2═Ca2++Cl-+ClO-+H2O |
16.下列说法不正确的是( )
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
| B. | 某物质的结构为 ,与其互为同分异构且完全水解后产物相同的油脂有两种 ,与其互为同分异构且完全水解后产物相同的油脂有两种 | |
| C. | 用溴水即可鉴别四氯化碳、2-己烯和甲苯 | |
| D. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
6.下列有关实验仪器的使用方法及实验操作正确的是( )
| A. | 蓝矾结晶水测定实验中,用坩埚钳取下坩埚放置在桌面上冷却 | |
| B. | 用试管夹夹持试管加热时,用手紧紧握住试管夹的长柄和短柄 | |
| C. | 测定中和反应的反应热时,将NaOH溶液一次性倒入盐酸中,并用环形玻璃搅拌棒搅动溶液 | |
| D. | 实验室从海带中提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取→蒸馏 |
13. 已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1.8×10-10,且Ksp(AgCl)>Ksp(AgI).如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )
已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1.8×10-10,且Ksp(AgCl)>Ksp(AgI).如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )
 已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1.8×10-10,且Ksp(AgCl)>Ksp(AgI).如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )
已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1.8×10-10,且Ksp(AgCl)>Ksp(AgI).如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )| A. | 原AgNO3溶液的物质的量浓度为0.1 mol•L-1 | |
| B. | 图中X点的坐标为(10,6) | |
| C. | 图中X点对应溶液中Ag+与Cl-的浓度不相同 | |
| D. | 若把0.1 mol•L-1的NaCl溶液换成0.1 mol•L-1的NaI溶液,则图象在终点后变为虚线部分 |
10.列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | CaSO3是难溶物 | 向CaCl2溶液中通入SO2产生白色沉淀 |
| B | 明矾能水解生成Al(OH)3胶体 | 实验室用明矾与水反应制Al(OH)3 |
| C | SiO2是酸性氧化物 | SiO2与任何酸均不反应 |
| D | Zn具有还原性和导电性 | 可用作锌锰干电池的负极材料 |
| A. | A | B. | B | C. | C | D. | D |
11.下列说法正确的是( )
| A. | 酸、碱、盐都是电解质 | |
| B. | H2O与D2O互称同素异形体 | |
| C. | 石油的分馏和裂化均属于化学变化 | |
| D. | 只含共价键的物质,一定是共价化合物 |
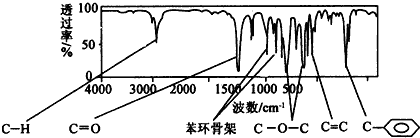
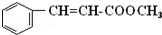 .
.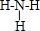 ,D2C含有的化学键类型为离子键;
,D2C含有的化学键类型为离子键; ;
;