题目内容
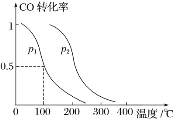
【题目】某兴趣小组用数字实验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到如图所示曲线。下列分析错误的是( )
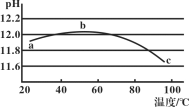
A.b点水解程度最大
B.水的电离平衡也会对溶液的pH产生影响
C.a→b段水解平衡向右移动
D.水解是吸热过程
【答案】A
【解析】
溶液中存在碳酸根的水解平衡![]() 和水的电离平衡
和水的电离平衡![]() ;图中显示温度升高溶液的碱性先增强后减弱,水的电离是吸热过程,纯水中温度升高pH值会降低,碳酸钠溶液中温度升高pH有增大的过程,说明水解受到促进,即水解为吸热过程;后pH值下降,说明温度升高水电离出更多的氢氧根抑制了碳酸根的水解,据此分析作答。
;图中显示温度升高溶液的碱性先增强后减弱,水的电离是吸热过程,纯水中温度升高pH值会降低,碳酸钠溶液中温度升高pH有增大的过程,说明水解受到促进,即水解为吸热过程;后pH值下降,说明温度升高水电离出更多的氢氧根抑制了碳酸根的水解,据此分析作答。
A.根据分析可知水解是吸热过程,温度越高,水解程度越大,故A错误;
B.随温度升高,此时促进盐类水解,对水的电离也起到促进作用,水电离出的氢氧根离子浓度抑制水解平衡,导致溶液pH值减小,因此水的电离平衡也对pH产生影响,故B正确;
C. a→b段说明升温促进水解,氢氧根离子浓度增大,碱性增大溶液pH增大,图象符合,故C正确;
D.根据分析可知水解是吸热过程,故D正确;
故答案为A。

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
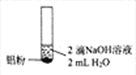
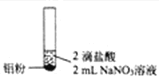
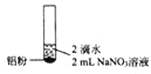
【题目】某同学进行如下实验![]() 溶液的浓度均为
溶液的浓度均为![]() 。
。
编号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 产生无色气泡 | 产生无色气泡液面上方呈浅红棕色 | 产生无色气泡 |
下列对实验现象的解释或推测不合理的是
A.![]() 中:
中:![]()
B.根据上述实验判断,![]() 的氧化性强于水
的氧化性强于水
C.![]() 中:
中:![]()
D.![]() 中使湿润pH试纸变蓝的气体是
中使湿润pH试纸变蓝的气体是![]()